Остеоартроз – лечение, симптомы и причины
Остеоартроз
Остеоартроз (ОА) — распространенное заболевание суставов, причем прослеживается тенденция к росту числа случаев ОА: за последнее десятилетие первичная заболеваемость в РФ выросла на 20 %, а общая распространенность — на 48 % [1]. При этом ОА коленного сустава входит в число основных причин потери нетрудоспособности как у мужчин, так и у женщин [1].
Понятие и классификация остеоартроза
При остеоартрозе преимущественно поражаются несущие вес суставы: коленные, бедренные, плечевые и суставы пояснично-крестцового отдела. Сравнительное исследование 2011 года показало, что местный анальгетик капсаицин в качестве обезболивающего препарата при ОА на 50 % эффективнее, чем плацебо. Ингибитор обратного нейронального захвата серотонина и норадреналина, антидепрессант III поколения дулоксетин эффективнее плацебо купирует боль при ОА.
ОА представляет собой гетерогенную группу состояний различной этиологии и схожими биологическими, морфологическими и клиническими проявлениями. При ОА преимущественно поражаются несущие вес суставы: коленные, бедренные, плечевые и суставы пояснично-крестцового отдела. Могут пострадать дистальные и проксимальные межфаланговые суставы, пястно-запястные суставы, однако подобная локализация встречается гораздо реже. В развитии заболевания важную роль играют ежедневные нагрузки, которые большей частью даются на несущие суставы.
Первичным, или идиопатическим, считается остеоартроз, причина которого остается неустановленной. Он может быть локальным (поражены один или два сустава) и генерализованным (поражены три и более суставов). Локальный ОА чаще всего ассоциируется с поражением коленных суставов (гонартроз) и тазобедренных суставов (коксартроз). При вторичном ОА существует очевидная причина болезни: травма, метаболические нарушения, другие ревматологические заболевания в анамнезе и так далее.
Факторы риска остеоартроза
Причины возникновения остеоартроза суставов могут быть следующие:
- возраст
- ожирение
- травма
- наследственность (фамильная история ОА)
- низкий уровень эстрогенов у женщин
- мышечная слабость
- особенности труда (например, регулярные тяжелые физические нагрузки)
- инфекция
- акромегалия
- воспалительный артроз в анамнезе (например, ревматоидный артрит)
- наследственные метаболические нарушения (например, алкаптонурия, гемохроматоз, болезнь Вильсона)
- гемоглобинопатии (к примеру, серповидноклеточная анемия, талассемия)
- невропатические расстройства, ведущие к развитию сустава Шарко (сирингомиелия, спинная сухотка, сахарный диабет)
- морфологические факторы риска (например, врожденный вывих бедра)
- поражение костной ткани (болезнь Педжета, асептический некроз и другие)
- хирургические вмешательства на суставах в анамнезе (к примеру, менискэктомия)
Патофизиология ОА
Васкуляризация хряща — особенность развития остеоартроза. Кровеносные сосуды прорастают хрящевое продолжение суставной поверхности, и с субхондральной зоны начинается окостенение суставной капсулы
Первичный и вторичный ОА имеют общую патологическую основу. Раньше предполагалось, что ОА — это дегенеративное расстройство, возникающее вследствие биохимического распада гиалинового хряща в синовиальных суставах. Однако сегодня принята несколько иная точка зрения, которая предполагает, что страдает не только суставной хрящ, но и весь сустав, в том числе субхондральная кость, синовиальная оболочка и близлежащие ткани.
Несмотря на дегенеративную природу ОА, появляется все больше свидетельств того, что после синтеза хондроцитами и выброса в суставную полость цитокинов развивается воспалительный процесс. Провоспалительные медиаторы (цитокины интерлейкин-1 и фактор некроза опухоли) не участвуют в деградации матрицы [2], а активируют хондроциты поверхностного слоя хряща, что увеличивает синтез матричных металлопротеиназ и, следовательно, дегенерацию суставного хряща.
В начальной стадии ОА из‑за повышения синтеза протеогликанов — основного компонента матрикса — происходит отек хряща. Этот этап может продолжаться несколько лет или даже десятилетий, и его основное проявление — это гипертрофия суставного хряща.
Далее, по мере прогрессирования ОА, уровень протеогликанов снижается до крайне низких значений, и изменяется их качественный состав. Поврежденный хрящ подвергается перегрузкам, вследствие чего повышается синтез металлопротеиназ (коллагеназы, стромелизина и других). Они способствуют дальнейшему разрушению протеогликанов и всей коллагеновой сети, что и предопределяет прогрессирующую дегенерацию хряща. В результате хрящ смягчается и теряет эластичность и повреждается все сильнее. Микроскопически на гладкой поверхности суставного хряща на этой стадии заболевания заметны шелушение и вертикальные расселины.
Для ОА характерны васкуляризация хряща и изменения в субхондральной кости. В ней формируется активно минерализующийся остеоид, а затем образуются субхондральные кисты и микропереломы. Это приводит к развитию субхондрального склероза.
Дифференциальная диагностика
Начальная цель, стоящая перед врачом, — дифференциация ОА от артритов, в том числе ревматоидного. Дифференциальная диагностика основывается на данных физического обследования и истории болезни. Картину дополняет рентгенологическое обследование и лабораторные показатели.
Симптомы остеоартроза
Типичные симптомы, требующие лечения:
- боль в суставах (первый признак заболевания, может появляться на ранних стадиях),
- снижение амплитуды движения, крепитация — хруст в суставах (часто присутствует),
- чувство скованности во время или после отдыха. После сна характерна скованность суставов — обычно менее 30 минут.
Симптомы при остеоартрозе кистей:
- чаще всего поражаются дистальные межфаланговые суставы,
- могут поражаться проксимальные межфаланговые суставы и суставы у основания большого пальца,
- узлы Гебердена (пальпируемые остеофиты в дистальных межфаланговых суставах) более характерны для женщин, чем для мужчин,
- воспалительные изменения, как правило, отсутствуют или остаются незамеченными (маловыраженными).
Ревматоидный артрит (РА) преимущественно поражает запястья, а также метакарпофаланговые и проксимальные межфаланговые суставы. Поражение дистальных межфаланговых или суставов пояснично-крестцового отдела для него нехарактерно. Кроме того, РА связан с длительной (более 1 часа) утренней скованностью, припухлостью и повышением температуры суставов.
Также ОА следует дифференцировать от:
- аваскулярный некроз костной ткани
- фибромиалгия
- подагра и псевдоподагра
- анкилозирующий спондилоартрит
- нейропатическая артропатия (сустав Шарко)
- болезнь Лайма
- пателлофеморальный синдром
- псориатический артрит
Диагностика
Диагностика остеоартроза основана на данных клинического и рентгенологического обследования. В клинических исследованиях изучались возможности определения количества аутоантител и маркеров синовиальной жидкости как индикаторов ОА [4]. Ни один из этих показателей не доказал своей надежности для диагностики и контроля ОА.
Как правило, показатели острой фазы воспаления при ОА находятся в пределах нормы. В случае эрозивного артрита возможно повышение СОЭ. В синовиальной жидкости определяются лейкоциты в количестве ниже 2000 в мкл, с преобладанием мононуклеаров.
Метод выбора в диагностике ОА — рентгенографическое исследование [5]. Некоторые особенности суставного хряща и мягких тканей, которые не отображаются на рентгенограмме, можно визуализировать с помощью МРТ. Однако у большинства пациентов с ОА в проведении МРТ нет необходимости.
УЗИ не играет роли в повседневной клинической оценке пациента с ОА. Оно может применяться в качестве инструмента для мониторинга дегенерации хряща, а также для проведения внутрисуставных инъекций.
Артроцентез может помочь исключить воспалительный артрит, инфекции или кристаллическую артропатию, ассоциированную с отложением микрокристаллов различного состава.
От результатов диагностики зависит какие методы будут применяться для лечения остеоартроза.
Терапия
Лечение остеоартроза направлено на купирование болевого синдрома и улучшение функционального состояния сустава. В оптимальном варианте пациенты должны получать комбинацию нефармакологических методик и фармакотерапии [6].
Катализируют воспалительную реакцию в суставе циклооксигеназа (ЦОГ) и липоксигеназа (ЛОГ), продуцирующие медиаторы воспаления и боли (простагландины, в том числе простагландин Е2 и лейкотриены). Последние, помимо прямого участия в патогенезе воспаления, снижают порог восприятия боли в пораженном суставе, тем самым усиливая болевые ощущения

Немедикаментозные способы контроля ОА:
- нормализация веса [7]
- лечебная гимнастика
- физиотерапия
- трудотерапия
- разгрузка некоторых суставов (например, колена, бедра)
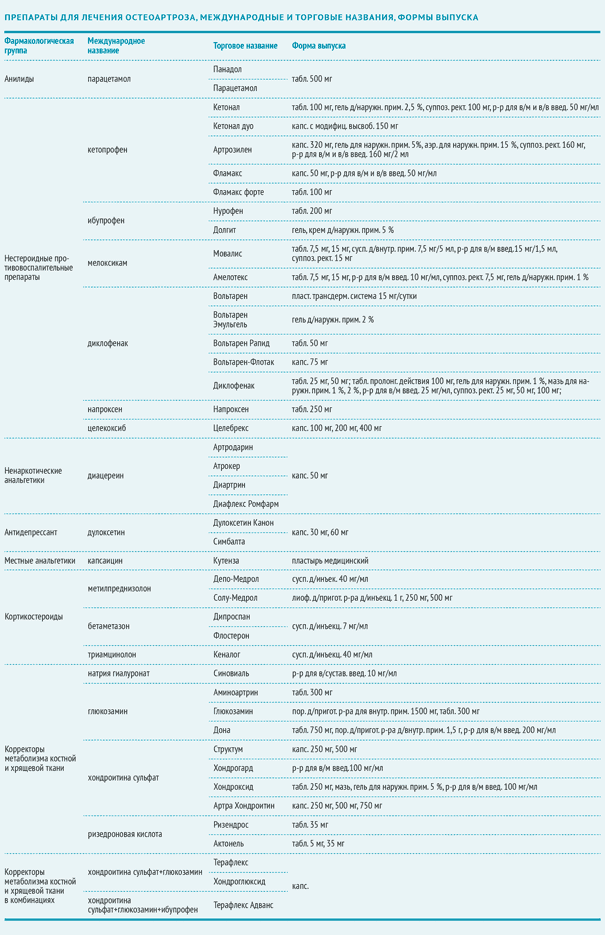
Фармакотерапия ОА, рекомендации Международного общества по изучению ОА (OARSI), 2014 год
Применяют следующие препараты для лечения остеоартроза:
Парацетамол
Медиаторы воспаления способны стимулировать ангиогенез. Так, гипоксия, которая часто возникает при воспалительном процессе, стимулирует синтез фактора роста сосудистого эндотелия (VEGF). Рост сосудов могут стимулировать также фибриноген и клетки воспаления: макрофаги, лимфоциты, тучные клетки и фибробласты.
Мета-анализ 2010 года подтвердил эффективность парацетамола в качестве умеренного обезболивающего средства при ОА [8]. Однако исследования показали повышенный риск побочных эффектов, ассоциированных с применением парацетамола, включая желудочно-кишечные (ЖК) проявления и мультиорганные нарушения [8]. В связи с этими данными OARSI рекомендует применять препарат строго в соответствии с дозировкой и длительностью курса.
Капсаицин
Сравнительное двойное слепое рандомизированное исследование 2011 года с участием 100 пациентов с ОА коленного сустава показало, что местный анальгетик капсаицин в качестве обезболивающего препарата при остеоартрозе на 50 % эффективнее, чем плацебо [9].
Кортикостероиды (интраартикулярные инъекции)
Последние исследования демонстрируют клинически значимый краткосрочный анальгетический эффект [10]. Есть еще несколько рекомендуемых препаратов для лечения остеоартроза.
Хондроитин
Четыре исследования, изучающие применение хондроитина при ОА, показали неоднозначные результаты. В одних испытаниях было выявлено некоторое обезболивающее действие, а в других эффект хондроитина не отличался от эффективности плацебо [11]. Кроме того, специалисты Международного общества по изучению ОА — OARSI отмечают высокую степень неоднородности исследований и низкое их качество, в связи с чем окончательная оценка эффективности хондроитина крайне затруднена. Таким образом, в качестве симптоматического средства эффект хондроитина признан сомнительным, а в качестве препарата для лечения ОА не рекомендуется.
Диацереин
Мета-анализ 2010 года, изучающий данные шести исследований с участием 1533 пациентов, выявил относительно умеренный, но статистически значимый обезболивающий эффект ненаркотического анальгетика диацереина по сравнению с плацебо [12]. В мета-анализе также отмечено значительное увеличение риска диареи среди добровольцев, принимающих диацереин. Однако диацереин признан более безопасным, чем НПВП.
Дулоксетин
Исследования доказали, что ингибитор обратного нейронального захвата серотонина и норадреналина, антидепрессант III поколения дулоксетин эффективнее плацебо купирует боль при ОА [13]. Однако 16,3 % пациентов, получающих дулоксетин, испытывают побочные эффекты (по сравнению с 5,6 % в группе плацебо). К ним относятся тошнота, сухость во рту, сонливость, усталость, снижение аппетита, гипергидроз. В связи с этим необходимость в применении дулоксетина для лечения ОА у лиц с сопутствующими заболеваниями (сахарный диабет, артериальная гипертензия и другие сердечно-сосудистые заболевания, почечная недостаточность, ЖК-кровотечения, депрессия, ограничение физической активности, в том числе и вследствие ожирения) признана сомнительной*.
Глюкозамин
Мета-анализ трех рандомизированных контролируемых исследований обнаружил позитивный эффект применения порошка шиповника (5 г/день) в качестве обезболивающего средства при ОА по сравнению с плацебо, однако эти данные нуждаются в дальнейшем изучении.
Два крупных исследования, оценивавших эффективность глюкозамина в лечении ОА дали противоречивые результаты [6]. Одно исследование показало статистически значимый анальгетический эффект, а другое засвидетельствовали отсутствие такового. Последний мета-анализ, в который вошло масштабное исследование, не доказал эффективности глюкозамина вовсе. На основании этих данных специалисты OARSI пришли к выводу о сомнительной эффективности глюкозамина в качестве симптоматического средства при ОА. В качестве средства для лечения ОА не рекомендуется [6].
Гиалуроновая кислота (интраартикулярные инъекции)
Результаты клинических исследований (КИ), изучающих эффективность интраартикулярного введения гиалуроновой кислоты (ГК), оказались спорными [6]. Противоречивые данные мета-анализов и отдельных исследований ставят под сомнение целесообразность применения препаратов гиалуроновой кислоты при ОА коленного и тазобедренного суставов. При ОА нескольких суставов ГК не рекомендуется.
Пероральные НПВП
Прием данных препаратов входит в рекомендации по лечению остеоартроза пациентам без сопутствующих заболеваний. При сопутствующих заболеваниях ЖКТ необходимо наряду с НПВП назначать ингибиторы протонной помпы. Пациентам из группы высокого риска (ЖК-кровотечение, инфаркт миокарда, хроническая почечная недостаточность в анамнезе) пероральные НПВП категорически не рекомендуются.
Ризедроновая кислота
Обзор литературы, проведенный японскими учеными в 2010 году, свидетельствует, что высокие дозы ризедроновой кислоты не уменьшают выраженность симптомов ОА, однако могут способствовать ослаблению прогрессирования ОА, сохраняя структурную целостность субхондральной кости [14]. Лабораторно этот эффект проявляется снижением уровня маркера деградации хряща CTX–II. Таким образом, эффективность резидроновой кислоты требует дальнейшего изучения.
Опиоиды
Исследования показали умеренную эффективность кодеина и морфина при ОА коленного и бедренного сустава. Мета-анализ 2006 года, проведенный Кокрановским сообществом по результатам плацебоконтролируемых исследований с участием 1019 пациентов, выявил статистически значимые преимущества трамадола по сравнению с плацебо [15].

- Фоломеева О. М., Эрдес Ш. Ф. Распространенность и социальная значимость ревматических заболеваний в Российской Федерации // Доктор (ревматология). 2007. № 10. С. 3–12.
- Poole AR. An introduction to the pathophysiology of osteoarthritis. Front Biosci. 1999 Oct 15. 4: D662–70.
- van Baarsen LG et al. Heterogeneous expression pattern of interleukin 17A (IL-17A), IL-17F and their receptors in synovium of rheumatoid arthritis, psoriatic arthritis and osteoarthritis… Arthritis Res Ther. 2014. 16 (4):426.
- Brandt KD. A pessimistic view of serologic markers for diagnosis and management of osteoarthritis. Biochemical, immunologic and clinicopathologic barriers. J Rheumatol Suppl. 1989 Aug. 18:39–42.
- Recht MP et al. Abnormalities of articular cartilage in the knee: analysis of available MR techniques. Radiology. 1993 May. 187 (2):473–8.
- Zhang W et al. OARSI recommendations for the management of hip and knee osteoarthritis, part I: critical appraisal of existing treatment guidelines and systematic review of current research evidence. Osteoarthritis Cartilage. 2007 Sep. 15 (9):981–1000.
- Felson DT et al. Weight loss reduces the risk for symptomatic knee osteoarthritis in women. The Framingham Study. Ann Intern Med. 1992 Apr 1. 116 (7):535–9.
- Bannuru RRDU, McAlindon TE. Reassessing the role of acetaminophen in osteoarthritis: systematic review and meta-analysis. Osteoarthritis Research Society International World Congress, 2010 Sep 23–26, Brussels, Belgium. Osteoarthritis Cartilage 2010, 18 (Suppl 2):P 250.
- Kosuwon W et al. Efficacy of symptomatic control of knee osteoarthritis with 0.0125 % of capsaicin versus placebo. J Med Assoc Thai¼Chotmaihet Thangphaet 2010, 93 (10):118e95. Epub 2010/10/27.
- Bannuru RR et al. Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis: a systematic review and meta-analysis. Arthritis Rheum 2009, 61 (12):1704–11.
- McAlindon T. E. et al. OARSI guidelines for the non-surgical management of knee osteoarthritis //Osteoarthritis and Cartilage. — 2014. — Т. 22. — №. 3. — С. 363–388.
- Bartels EM et al. Symptomatic efficacy and safety of diacerein in the treatment of osteoarthritis: a meta-analysis of randomized placebo-controlled trials. Osteoarthritis and Cartilage/OARS. Osteoarthritis Research Society 2010, 18 (3):289–96.
- Citrome L, Weiss-Citrome A. A systematic review of duloxetine for osteoarthritic pain: what is the number needed to treat, number needed to harm, and likelihood to be helped or harmed? Postgrad Med 2012, 124 (1):83.
- Iwamoto J. et al. Effects of risedronate on osteoarthritis of the knee //Yonsei medical journal. 2010. №. 2. 164–170 pp.
- Cepeda MS, Camargo F, Zea C, Valencia L. Tramadol for oste-oarthritis. Cochrane Database Syst Rev 2006, (3):CD005 522. Epub 2006/07/21.



