Вирус папилломы человека: патогенез и коррекция иммунных нарушений - Журнал Доктор Ру
Вирус папилломы человека: патогенез и коррекция иммунных нарушений
Цель обзора: представить актуальную информацию по особенностям эпидемиологии, патогенеза поражений шейки матки, ассоциированных с вирусом папилломы человека (ВПЧ), и сопутствующих иммунных нарушений на основании анализа данных, представленных в поисковых системах Pubmed, Google Scholar, Embase.
Основные положения. Клинические проявления ВПЧ включают развитие неопластических процессов шейки матки, вульвы, вагины, прямой кишки. Основным лечебным подходом при выявлении ВПЧ-ассоциированных поражений шейки матки является удаление пораженных тканей хирургическим путем, что не всегда эффективно, поскольку использование только хирургических процедур в 20–30% случаев приводит к возникновению рецидивов заболевания и персистенции вируса как в обработанных областях, так и в de novo регистрируемых очагах поражения. Патогенетические особенности ВПЧ-ассоциированных заболеваний обусловлены эволюционными аспектами развития и взаимодействия в системе «ВПЧ — макроорганизм», связаны с антимикробным потенциалом, активностью Toll-подобных рецепторов 4, 9, балансом Th1/Th2, соотношением вырабатываемых субпопуляциями Т-хелперов цитокинов и сдвигом иммунологической активности в направлении Th2.
Заключение. Препарат Иммуномакс — кислый пептидогликан растительного происхождения, распознаваемый Toll-подобными рецепторами клеток, реализующих иммунный надзор в организме, — активирует противовирусные механизмы иммунного ответа при ВПЧ-инфекции.
Вклад авторов: Гизингер О.А. — разработка концепции статьи, сбор материала, написание обзора, оформление рукописи для публикации, Радзинский В.Е. — редактирование и утверждение рукописи для публикации.
Конфликт интересов: авторы заявляют об отсутствии возможных конфликтов интересов.
Гизингер Оксана Анатольевна (автор для переписки) — профессор кафедры микробиологии и вирусологии Медицинского института ФГАОУ ВО РУДН, д. б. н., профессор. 117049, Россия, г. Москва, ул. Миклухо-Маклая, д. 8. eLIBRARY.RU SPIN: 7205-1836. https://orcid.org/0000-0001-9302-0155. E-mail: [email protected]
Радзинский Виктор Евсеевич — член-корреспондент РАН, д. м. н., профессор, заведующий кафедрой акушерства и гинекологии с курсом перинатологии Медицинского института ФГАОУ ВО РУДН. 117198, Россия, г. Москва, ул. Миклухо-Маклая, д. 6. eLIBRARY.RU SPIN: 4507-7510. https://orcid.org/0000-0003-4956-0466. E-mail: [email protected]
Генитальная папилломавирусная инфекция — одна из самых частых ИППП [1, 2] . ВПЧ обладает тропностью к эпителиоцитам слизистой оболочки аногенитального тракта, верхних дыхательных путей, эпителиоцитов, кожных покровов [1] . К клиническим проявлениям ВПЧ-инфекции относятся доброкачественные, предраковые и раковые образования шейки матки, ануса, вагины, вульвы, полового члена и ротоглотки [2] . Среди ВПЧ-ассоциированных раков у женщин встречаются раки следующих локализаций: шейки матки (49–50%), ануса (14–18%), орофарингеальный рак (14%), рак вульвы (15–16%), вагины (3–4%), прямой кишки (2%) [3, 4] . Рак шейки матки имеет высокую социальную значимость не только среди ВПЧ-ассоциированных онкологических заболеваний, но и в целом в структуре онкологической заболеваемости и смертности: по данным 2020 г., он по-прежнему занимает 4-е место среди причин заболеваемости и смертности среди раков у женщин [5] . Рак шейки матки часто диагностируется у женщин репродуктивного и работоспособного возраста. Недостаточно изученными, хотя и находящимися в поле пристального внимания исследователей и практических врачей, являются данные о ВПЧ-ассоциированных поражениях яичников, мочевого пузыря, почек [3, 6] . Согласно результатам ряда российских и зарубежных исследователей, ВПЧ был обнаружен в 26% случаев в ткани яичников при наличии в них пролиферативного процесса [5, 7] . Тревожным фактом является то, что частота встречаемости ВПЧ в тканях карциномы яичников гораздо выше, чем в контрольных образцах, в среднем на 42,0 ± 4,12%. Типы ВПЧ 16, 18, 45 имеют положительную корреляцию с поздними стадиями рака яичников, в то время как в здоровой ткани яичников типы ВПЧ 6, 11 присутствовали в незначительном проценте случаев [8] . Представлены данные о положительной молекулярно-генетической детекции ВПЧ высокого онкогенного риска при раке мочевого пузыря, когда количество ПЦР-позитивных результатов составило 52,4 ± 3,10%, ВПЧ 16-го типа преобладал в 95,5% гистологических образцов опухоли мочевого пузыря [9] . ВПЧ обнаруживали в 30,3% клеточных образцов рака почек и в 4,1% образцов перитуморальных тканей [10] . Выявлена связь между инфицированием ВПЧ высокого канцерогенного риска и наличием онкомаркеров AFP, CEA, CA 125, CA 19-9 в сыворотке крови у пациенток с опухолевыми процессами репродуктивной системы [11] . С ВПЧ-ассоциированными поражениями эндометрия ситуация принципиально иная. Известно, что в процессе заражения, реинфицирования и распространения из эндоцервикса ВПЧ может инфицировать эндометрий. Число работ, указывающих на такое «поведение» вируса в организме, его эпидемиологические и патогенетические особенности, увеличивается с каждым годом [2] . Гистологические особенности, связанные с персистированием ВПЧ в эндометрии, представлены широким спектром клеточных изменений: исследуя гистологические препараты некоторых видов аденосквамозной карциномы эндометрия, специалисты выявили характерные признаки инфицированности ВПЧ: койлоцитоз, папиллярные выпячивания, эозинофильные включения в ядрах, нарушение ядерно-цитоплазматического соотношения [12] . Такие находки заставляют задумываться о роли вируса в канцерогенезе эндометриальных поражений [13] . Частота выявления вируса при хроническом эндометрите и гиперплазии эндометрия различна и, по данным разных авторов, составляет от 9,1% до 46% [12] . Высокий процент выявления и широкий разброс статистических данных заставляет серьезно задуматься о проблеме распространения и персистенции ВПЧ в организме, позволяет предположить участие вируса в патогенезе некоторых заболеваний репродуктивной системы. В исследовании E.N. Fedrizzi и соавт. (2004) ВПЧ 16-го и 18-го типов был обнаружен в 8% препаратов с диагностированной карциномой эндометрия, в 10% — при отсутствии патологии эндометрия [8] . Еще больший процент выявления ВПЧ в биопсии тканей эндометрия — 47,2% против 13,2% в группе контроля — зарегистрирован M.A. Abu-Lubad (2020), наиболее часто встречались ВПЧ 16-го (69,7%) и 18-го (15,2%) типов [14] . Важные открытия были сделаны при исследовании патогенетической роли ВПЧ в развитии эндометриоза. В работе Р. Oppelt и соавт. ВПЧ высокого и среднего канцерогенного риска найден в очагах эндометриоза в 11,3% случаев [15] . Активация клеточной пролиферации с участием эндометриоидных клеток на фоне экспрессии вирусных антигенов обусловлена повышением активности матриксных металлопротеиназ (ММР-2 и ММР-9) и их тканевых ингибиторов 1-го и 3-го типов. Следствием усиления активности ММР-2 и ММР-9 становится повышение способности эндометриоидных клеток к инвазии при инфицировании ВПЧ [16] . Исследование [17] показало наличие ВПЧ высокого канцерогенного риска у 13 (18,8%) женщин с 1–2-й стадиями наружного генитального эндометриоза и у 22 (24,4%) с 3–4-й стадиями. Анализ эпидемиологических особенностей и распространенности ВПЧ среди социально и репродуктивно активных групп населения показывает его высокую частоту в популяции, ассоциацию с тяжелыми, социально значимыми заболеваниями, что обусловливает необходимость разработки эффективных методов, направленных на элиминацию вируса и коррекцию иммунных нарушений при папилломавирусной инфекции. Основным лечебным подходом после выявления ВПЧ-ассоциированных поражений является деструкция очагов поражения, но поскольку репликация ДНК ВПЧ происходит в клетках базального слоя, удаление пораженных тканей хирургическим путем не всегда эффективно. При предраковых поражениях использование только хирургических процедур в 20–30% случаев приводит к возникновению рецидивов как в обработанных областях, так и в de novo регистрируемых [18] . Имеющиеся сведения об иммуносупрессивном действии ВПЧ дают возможность обоснованно использовать методы терапии, влияющие на иммунопатогенез различных клинических форм ВПЧ-инфекции. КОРРЕКЦИЯ ИММУННЫХ НАРУШЕНИЙ ПРИ ВПЧ-АССОЦИИРОВАННЫХ ПОРАЖЕНИЯХ — КЛЮЧ К РАЗРАБОТКЕ МЕТОДОВ ТЕРАПИИ Роль иммунной системы в патогенезе вирусных инфекций доказана и подтверждена. У пациенток, имеющих в анамнезе иммунные нарушения, ВПЧ-инфекция встречается в 2 раза чаще, скорость канцерогенеза шейки матки выше в 10 раз по сравнению с общепопуляционными показателями [19] . Эволюционные аспекты развития и взаимодействия в системе «ВПЧ — макроорганизм» напрямую связаны с противовирусным потенциалом последнего. В зависимости от состояния факторов колонизационной резистентности инфицирование может приводить как к развитию заболевания, так и к его спонтанному разрешению [20] . Проникая в клетку, вирус использует клеточные системы человека для получения собственных пептидных систем и репликации своего ДНК. Гены, кодирующие белки вируса, носят название ранних (early), обозначаются E1–E8. E5 облегчает уклонение вируса от иммунного ответа макроорганизма путем нарушения регуляции генов главного комплекса гистосовместимости (MHС) класса 1, снижая распознание Т-цитотоксическими лимфоцитами (клетками с фенотипом CD8+) ВПЧ-инфицированных клеток. E6 ингибирует interferon regulatory factor 3 (IRF3) — транскрипционный (регуляторный) фактор 3 ИФН, который подавляет экспрессию ИФН-чувствительных генов [21] . E6 и E7 интегрируются в геном клетки-хозяина, вызывают пролиферацию, блокируют противоопухолевые эффекты белков p53 и Rb. Cинергизм эффектов рE6 и рE7 регулирует клеточный цикл за счет создания генетических девиаций (pRb и p53), что усиливает пролиферативную активность и выработку белка p16, кодируемого геном-супрессором опухолевого роста CDKN 2 , при снижении процессов апоптотической активности в направлении Bax каспаз, p53-зависимого проапоптотического белка Bax, увеличивающего проницаемость митохондрий и выход из них в цитоплазму цитохрома С [22] . Белок Е7 обладает уникальными свойствами, он ингибирует транскрипцию гена, ответственного за синтез распознающего рецептора TLR-9 1 (Toll-подобного рецептора), способного вызывать индукцию ИФН и провоспалительных цитокинов ИЛ-8, ИЛ-1β [23] . TLR 1–9 — ключевые молекулы иммунного ответа (врожденного и адаптивного), присутствующие в цитоплазме, распознающие антигенные структуры, они патогенетически связаны с развитием опухоли и ее прогрессией [23] . В патогенезе ВПЧ-инфекции доказана патогенетическая роль TLR-4, 9. Цервикальные эпителиоциты с низкой экспрессией TLR-9 были более чувствительны к инфекции ВПЧ, а клетки цервикального эпителия с высокой экспрессией TLR-9 редко содержали антиген ВПЧ, что обосновывает необходимость поиска средств, повышающих экспрессию TLR-9 для реализации противовирусной защиты [24] . Во время прогрессирования рака шейки матки экспрессия TLR-4 снижается, что может быть связано с гиперэкспрессией р16 INK 4 A — маркера интеграции ВПЧ в клетки хозяина [25] . Понимание роли TLR в патогенетических механизмах персистенции ВПЧ и формировании патологических процессов легли в основу создания нового поколения иммуномодулирующих препаратов, влияющих на механизмы сигналлинга и усиления распознавания патогенов структурами врожденного иммунитета, преодоления супрессии и повышения эффективности лечения ВПЧ-ассоциированных заболеваний. МЕХАНИЗМЫ ПРЕОДОЛЕНИЯ ИММУНОСУПРЕССИИ, ИНИЦИИРУЕМОЙ ВИРУСОМ ПАПИЛЛОМЫ ЧЕЛОВЕКА, С ИСПОЛЬЗОВАНИЕМ ПРЕПАРАТА ИММУНОМАКС Анализ патогенетической картины заболеваний, ассоциированных с ВПЧ, показал, что перспективным классом препаратов для лечения папилломавирусной инфекции являются агонисты TLR: TLR-4-, TLR-7-, TLR-8-, TLR-9-агонисты [26] . По механизму действия Иммуномакс — TLR-4-агонист, он способен активировать гены сигнальных путей TLR-3, TLR-4, TLR-9, RIG-I (retinoic acid-inducible gene 1). Роль Иммуномакса в активации генов RIG-I очень важна, поскольку RIG, являясь продуктом гена человека DDX 58 , участвует в антивирусном ответе системы врожденного иммунитета организма путем распознавания вирусного антигена. RIG-I распознает 5'-трифосфорилированные одноцепочечные РНК, двухцепочечные РНК и короткие фрагменты двухцепочечных РНК, участвует в запуске антивирусного клеточного ответа. По химической природе это кислый пептидогликан растительного происхождения [27] . Попадая в организм человека, Иммуномакс распознается с помощью TLR иммуноцитов как патоген-ассоциированная молекулярная структура (PAMP), что приводит к активации клеточного иммунного ответа против ВПЧ [28] . Анализ доказательной научной базы по клинико-иммунологической эффективности препарата Иммуномакс позволяет уверенно говорить о его способности комплементарно блокировать элементы рЕ6- и рЕ7-опосредованного канцерогенеза ( табл. 1 ). Таблица 1
Ингибирование препаратом Иммуномакс иммуносупрессивного потенциала рЕ6 и рЕ7 вируса папилломы человека (ВПЧ) [28–30] 2
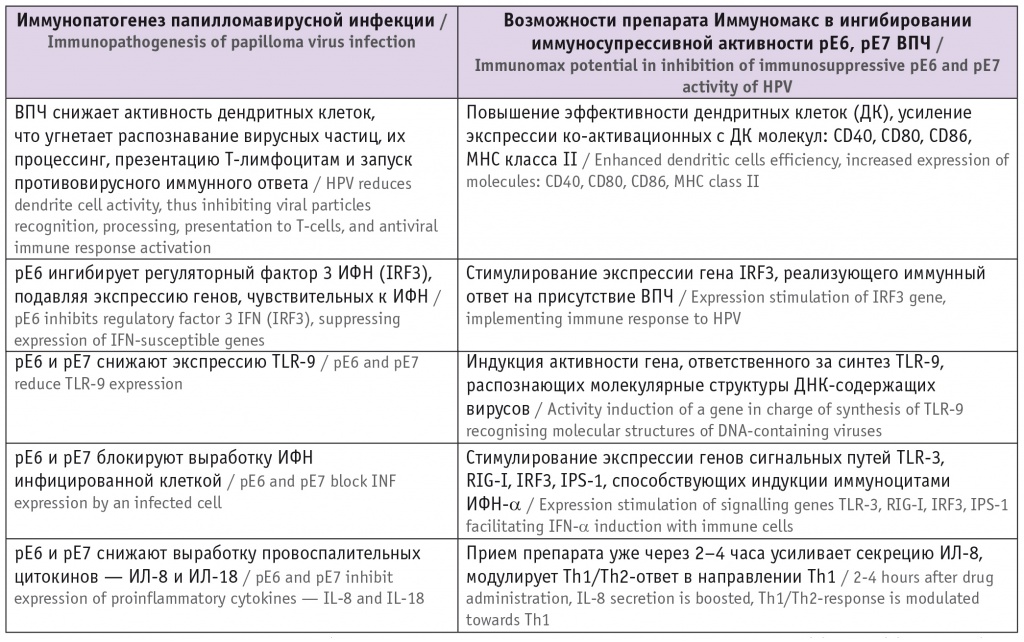
Примечание. Здесь и далее в таблицах: ИЛ — интерлейкин, ИФН — интерферон, TLR — Toll-подобные рецепторы, Th — Т-хелперы. ИММУНОТЕРАПИЯ КАК ГЛАВНЫЙ ФАКТОР В КОНЦЕПЦИИ КАНЦЕРОПРЕВЕНЦИИ ВПЧ-АССОЦИИРОВАННОГО РАКА ВПЧ-ассоциированный рак шейки матки является одной из основных причин смерти женщин от онкопатологии, но в то же время это в значительной степени предотвратимое заболевание. В августе 2020 г. Всемирная ассамблея ВОЗ поставила цель ликвидировать рак шейки матки, для чего приняла резолюцию, в которой представила врачам стратегию реализации данной цели [31] . В настоящее время предложено использование агонистов рецепторов врожденного иммунитета TLR в качестве иммуноадъювантов нового поколения, усиливающих противовирусную защиту. Ряд авторов предлагает рассматривать их в качестве перспективных профилактических и терапевтических средств борьбы с инфекционными заболеваниями [32] . Представляется очень важной и своевременной разработка препаратов, способных влиять на активность антибластомных факторов, составляющих основу противоопухолевого иммунитета ( табл. 2 ). Таблица 2
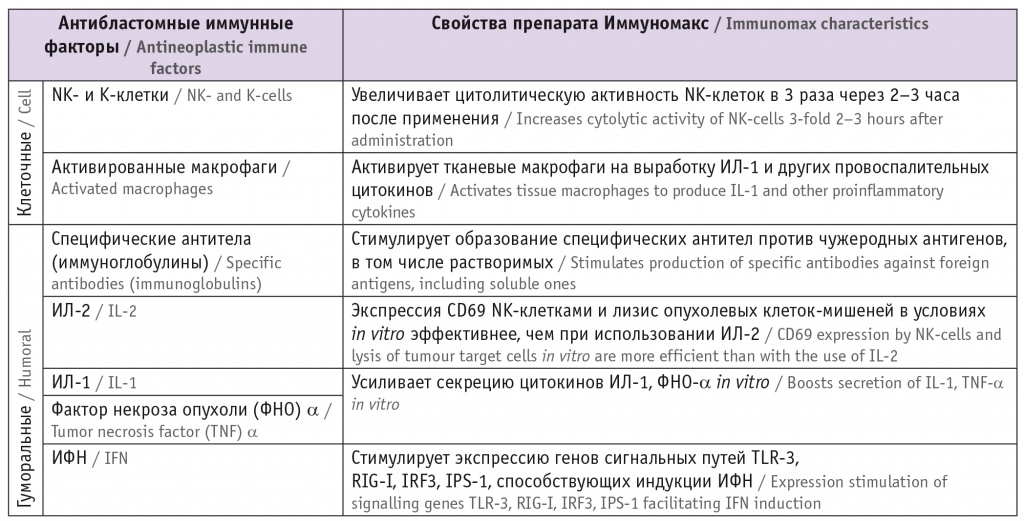
Антибластомные факторы, активируемые препаратом Иммуномакс [28, 30] 3

Примечание. Здесь и в таблицах далее: NK-клетки — NK-лимфоциты, натуральные киллеры. Канцеропревентивный потенциал препарата Иммуномакс описан в таблице 3 . Таблица 3
Канцеропревентивный потенциал препарата Иммуномакс в условиях in vitro и in vivo [30] 4
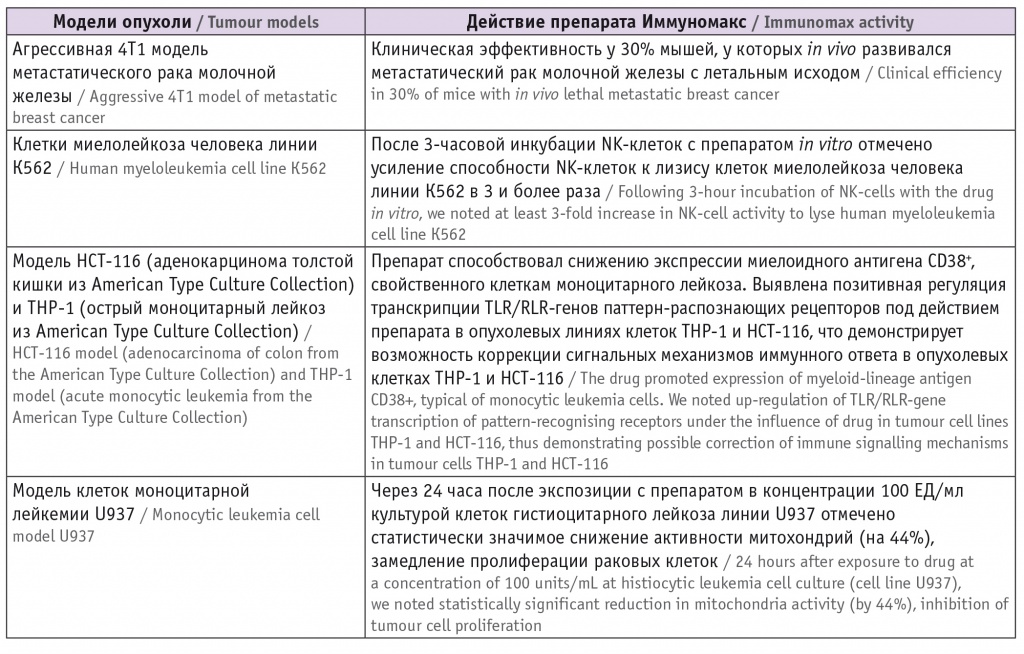
Одни и те же иммунные клетки под действием препарата могут проявлять двойственную активность в отношении опухоли: макрофаги типа М1, дендритные клетки 1-го типа, нейтрофилы N1 оказывают противоопухолевое действие, а макрофаги М2, дендритные клетки 2-го типа, нейтрофилы N2, наоборот, поддерживают канцерогенез [33, 34] . Поэтому выбор иммуномодулятора должен быть ответственным и научно обоснованным, чтобы не усилить канцерогенез ( табл. 4 ). Таблица 4
Поляризация активности ряда клеток иммунной системы с двойственной (проопухолевой и противоопухолевой) активностью при использовании препарата Иммуномакс [28–30]
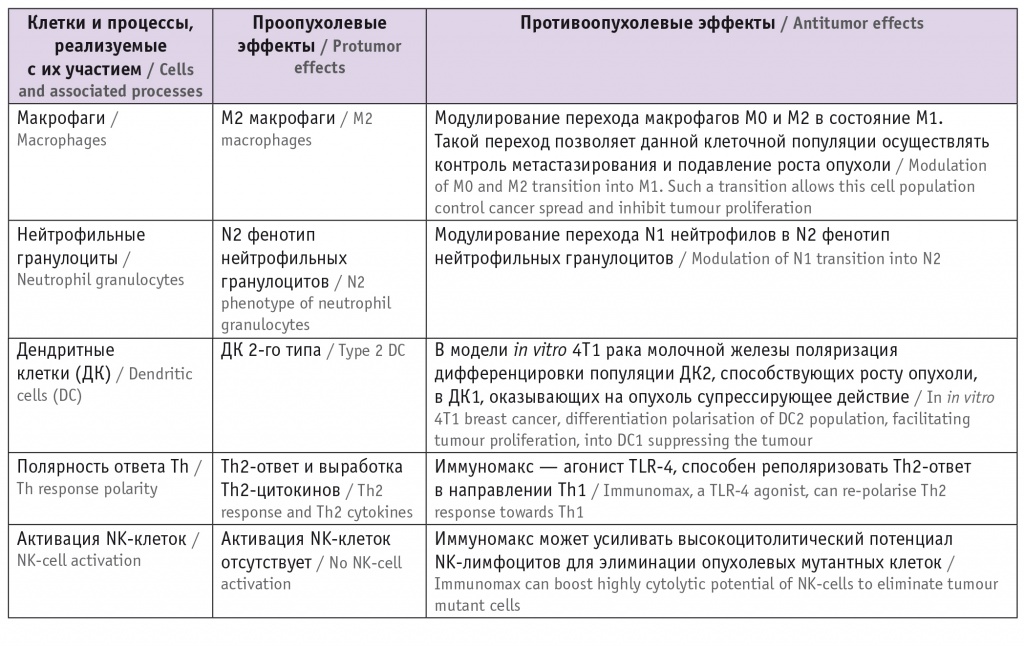
- обладает высоким канцеропревентивным потенциалом, что продемонстрировано в условиях in vitro ,
- может переводить иммуноциты из проопухолевого состояния в противоопухолевое (макрофаги М2 в М1, DC2 в DC1),
- реализует специфическое ингибирование механизмов иммуносупрессии, опосредованной активностью белков Е6 и Е7 ВПЧ,
- активирует антибластомные факторы, вырабатываемые в ответ на присутствие атипичных клеток.
На фоне лечения препаратом Иммуномакс наблюдалась ликвидация проявлений иммунной недостаточности, прежде всего в клеточном звене иммунной системы: восстанавливались абсолютная концентрация лимфоцитов и численность субпопуляций Т-хелперов (Th), повышались концентрация и функциональная активность NК-клеток, нормализовалось значение иммунорегуляторного индекса, улучшались функциональные характеристики клеточной иммунореактивности, формировалась Th1-девиация функционирования клеточного и цитокинового профиля 6 .
Поступила: 11.05.2021
Принята к публикации: 09.06.2021
1 TLR-9 — внутриклеточный рецептор 9, экспрессируется в эндоплазматическом ретикулуме, эндосомах, мультивезикулярных телах и лизосомах, связывает неметилированные мотивы ДНК CpG, которые распространены в бактериальной и вирусной ДНК.
2 Отчет о научно-исследовательской работе «Изучение in vitro влияния тестируемой субстанции препарата Иммуномакс® на выработку провоспалительных медиаторов клетками U937 (моноциты человека)». ЗАО «Санкт-Петербургский институт фармации», 2020.
4 Там же, Инструкция по медицинскому применению (Иммуномакс, лиофилизат для приготовления раствора для внутримышечного введения, Р N001919/02 от 17.10.2011).
6 Инструкция по медицинскому применению (Иммуномакс, лиофилизат для приготовления раствора для внутримышечного введения Р N001919/02 от 17.10.2011), Отчет о научно-исследовательской работе «Изучение in vitro влияния тестируемой субстанции препарата Иммуномакс® на выработку провоспалительных медиаторов клетками U937 (моноциты человека)»…
"