МЕЖДИСЦИПЛИНАРНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ «ЛЕЧЕНИЕ ОЖИРЕНИЯ И КОМОРБИДНЫХ ЗАБОЛЕВАНИЙ» | Дедов | Ожирение и метаболизм

МЕЖДИСЦИПЛИНАРНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ «ЛЕЧЕНИЕ ОЖИРЕНИЯ И КОМОРБИДНЫХ ЗАБОЛЕВАНИЙ»
Клинические рекомендации уже давно вошли в число рабочих инструментов современного врача, помогая ему быстро ориентироваться в наиболее эффективных доказанных методах лечения и профилактики различных заболеваний, а также адаптировать эти методы к конкретным задачам своих больных и добиваться максимальной персонализации лечения. Клинические рекомендации составляются профессиональными некоммерческими ассоциациями и одобряются научным советом МЗ РФ, при этом нередко одна рекомендация готовится двумя или даже тремя ассоциациями. Особенность предлагаемых вашему вниманию рекомендаций в том, что в профилактику и лечение ожирения вовлекаются не только эндокринологи, но и терапевты, кардиологи, гинекологи, гастроэнтерологи и врачи многих других специальностей. Мультидисциплинарная рабочая группа представляет этот проект в многопрофильном журнале с целью объединения усилий нескольких профессиональных ассоциаций, что связано с необходимостью уделить внимание не только самому ожирению, но и коморбидным состояниям. Мы надеемся на конструктивную критику и разностороннее обсуждение проблемы на страницах нашего журнала.
Ключевые слова
Для цитирования:
Дедов И.И., Шестакова М.В., Мельниченко Г.А., Мазурина Н.В., Андреева Е.Н., Бондаренко И.З., Гусова З.Р., Дзгоева Ф.Х., Елисеев М.С., Ершова Е.В., Журавлева М.В., Захарчук Т.А., Исаков В.А., Клепикова М.В., Комшилова К.А., Крысанова В.С., Недогода С.В., Новикова А.М., Остроумова О.Д., Переверзев А.П., Роживанов Р.В., Романцова Т.И., Руяткина Л.А., Саласюк А.С., Сасунова А.Н., Сметанина С.А., Стародубова А.В., Суплотова Л.А., Ткачева О.Н., Трошина Е.А., Хамошина М.Б., Чечельницкая С.М., Шестакова Е.А., Шереметьева Е.В. МЕЖДИСЦИПЛИНАРНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ «ЛЕЧЕНИЕ ОЖИРЕНИЯ И КОМОРБИДНЫХ ЗАБОЛЕВАНИЙ». Ожирение и метаболизм. 2021,18(1):5-99. https://doi.org/10.14341/omet12714
For citation:
Dedov I.I., Shestakova M.V., Melnichenko G.A., Mazurina N.V., Andreeva E.N., Bondarenko I.Z., Gusova Z.R., Dzgoeva F.K., Eliseev M.S., Ershova E.V., Zhuravleva M.V., Zakharchuk T.A., Isakov V.A., Klepikova M.V., Komshilova K.A., Krysanova V.S., Nedogoda S.V., Novikova A.M., Ostroumova O.D., Pereverzev A.P., Rozhivanov R.V., Romantsova T.I., Ruyatkina L.A., Salasyuk A.S., Sasunova A.N., Smetanina S.A., Starodubova A.V., Suplotova L.A., Tkacheva O.N., Troshina E.A., Khamoshina M.V., Chechelnitskaya S.M., Shestakova E.A., Sheremet’eva E.V. INTERDISCIPLINARY CLINICAL PRACTICE GUIDELINES MANAGEMENT OF OBESITY AND ITS COMORBIDITIES". Obesity and metabolism. 2021,18(1):5-99. (In Russ.) https://doi.org/10.14341/omet12714
ГЛАВА 1. ВВЕДЕНИЕ
Мазурина Н.В., Суплотова Л.А., Сметанина С.А., Руяткина Л.А.
ОПРЕДЕЛЕНИЕ
Ожирение - это хроническое заболевание, характеризующееся избыточным накоплением жировой ткани в организме, представляющим угрозу здоровью, и являющееся основным фактором риска ряда других хронических заболеваний, включая сахарный диабет 2 типа (СД2) и сердечно-сосудистые заболевания (ССЗ) [1-3].
ДИАГНОСТИКА ОЖИРЕНИЯ
Диагностику ожирения в клинической практике следует проводить в три этапа: на первом этапе установить диагноз ожирения на основании антропометрических параметров, на втором — выявить осложнения, ассоциированные с ожирением, на третьем — провести дифференциальную диагностику для исключения вторичного ожирения, связанного с эндокринной или синдромальной патологией.
1.1. В качестве первого этапа диагностики и скрининга ожирения для лиц старше 18 лет рекомендуется определение антропометрических показателей — измерение массы тела, роста и окружности талии (уровень достоверности доказательств (УДД) 1, уровень убедительности рекомендаций (УУР) А).
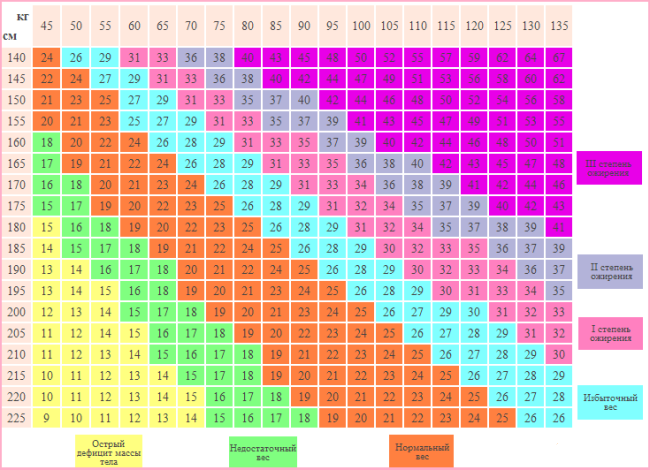
1.2. Для диагностики ожирения и определения его степени рекомендуется расчет индекса массы тела (индекс Кетле), который представляет собой показатель, равный массе тела пациента в килограммах, разделенной на рост в метрах в квадрате (УДД 1, УУР А):

При оценке ИМТ у лиц европеоидной расы нормальная масса тела соответствует значению ИМТ 18,5-24,9 кг/м 2 . При величине ИМТ ≥25 кг/м 2 масса тела расценивается как избыточная. При показателе ИМТ ≥30кг/м 2 масса тела оценивается как ожирение (табл. 1) [4].
Таблица 1. Классификация ожирения по индексу массы тела (ВОЗ, 1995 г. с дополнениями) [4]
у лиц европеоидной расы
ИМТ, кг/м 2 у лиц
Риск сопутствующих заболеваний
Дефицит массы тела
Низкий (повышен риск других заболеваний)
Нормальная масса тела
Избыточная масса тела
Ожирение I степени
Ожирение II степени
Ожирение III степени
1.3. У пациентов европеоидной расы для оценки риска осложнений, ассоциированных с ожирением, в клинической практике рекомендуется использовать классификацию ожирения по ИМТ (ВОЗ, 1997): ожирение I степени при ИМТ ≥30 кг/м 2 , ожирение II степени — при ИМТ ≥ 35 кг/м 2 и ожирение III степени — при ИМТ ≥40 кг/м 2 (УДД 1, УУР А) (табл. 1).
1.4. ИМТ не рекомендуется использовать для диагностики ожирения у пожилых людей, спортсменов, у лиц с чрезмерно развитой мускулатурой, беременных женщин, лиц с ампутированными конечностями, с выраженными отеками, поскольку данный показатель не является достоверно отражающим содержание жировой ткани в организме (УДД 1, УУР А).
Комментарии. ИМТ (индекс Кетле) позволяет косвенно судить о количестве жировой ткани в организме и диагностировать наличие низкой, нормальной, избыточной массы тела или ожирения [5-7]. Учитывая, что ИМТ ≥30 кг/м 2 у лиц европеоидной расы и ИМТ ≥25,0 кг/м 2 у лиц монголоидной расы в большинстве случаев ассоциирован с высоким содержанием жировой ткани в организме и, следовательно, является информативным и простым индикатором ожирения, достаточным в рутинной клинической практике в качестве первого этапа диагностики.
1.5. Другие методы оценки количества жировой ткани в организме, такие как биоэлектрический импеданс, плетизмография, двухэнергетическая рентгеновская абсорбциометрия, магнитно-резонансная томография и компьютерная томография могут использоваться в клинической практике в особых ситуациях, например, при наличии чрезмерно развитой мускулатуры, отеков, больших образований, низко-рослости, после ампутаций конечностей, при саркопении, у пожилых лиц (УДД 3, УУР С).
Комментарии. Клиническая значимость таких методов определения содержания жировой ткани в организме, как биоэлектрический импеданс, плетизмография, двухэнергетическая рентгеновская абсорбциометрия, ограничивается наличием, стоимостью и отсутствием исходных данных для валидированных точек. Золотым стандартом оценки количества подкожного и висцерального жира является магнитно-резонансная или компьютерная томография [7, 8]. Однако данные методы диагностики не подходят для рутинной клинической практики, так как они достаточно трудоемкие, дорогостоящие и вредны для здоровья при частом использовании. В настоящее время не получено убедительных данных, демонстрирующих, что более сложные методы диагностики ожирения более эффективны в работе с пациентами с ожирением.
1.6. У лиц европеоидной расы с ИМТ ≥25,0 кг/м 2 и у лиц монголоидной расы c ИМТ ≥23,0 кг/м 2 рекомендуется измерение окружности талии в качестве простого и информативного метода диагностики абдоминального ожирения (УДД 1, УУР А). Значения ОТ >80 см у женщин и ОТ ≥94 см у мужчин соответствуют абдоминальному ожирению и повышенному риску сердечно-сосудистых событий (УДД 1, УУР А) [4,9-13].
Комментарии. Высокий показатель ОТ у лиц с ИМТ ≥ 25 кг/м 2 связан с риском развития сахарного 2 типа, дислипидемии, артериальной гипертонии и сердечно-сосудистых заболеваний [13-15]. ОТ - уникальный индикатор распределения жировой ткани, который коррелирует с количеством абдоминального жира, является простым и недорогим методом для диагностики абдоминального ожирения [13-15]. Определение ОТ позволяет в рутинной клинической практике выявлять пациентов с высоким кардиометаболическим риском в большей степени, чем ИМТ [13-15].
В соответствии с протоколом Всемирной организации здравоохранения измерение ОТ должно производиться стоя без обуви, при плавном выдохе, при упоре на обе стопы и с руками, свободно вытянутыми вдоль туловища в средней точке между нижним краем последнего прощупываемого ребра и верхней частью гребня подвздошной кости. Измерительная лента должна быть изготовлена из материала, не поддающегося легкому растяжению. Лента должна располагаться перпендикулярно длинной оси тела и параллельно полу и иметь достаточное натяжение для обеспечения точности измерения. Измерения, как правило, выполняют два раза и регистрируются с точностью до 0,1 см [4].
Другие антропометрические индексы ожирения (например, коэффициент отношения ОТ к росту, индекс «продукта накопления липидов», индекс висцерального ожирения и прочие) не рекомендуются к применению в рутинной клинической практике в связи с отсутствием достоверных данных о связи с абдоминальным ожирением и кардиоваскулярными событиями, а также из-за отсутствия крупномасштабных исследований по их оценке среди взрослых в Российской популяции.
ОСОБЕННОСТИ ДИАГНОСТИКИ ОЖИРЕНИЯ В АЗИАТСКОЙ ПОПУЛЯЦИИ
1.7. При интерпретации ИМТ у лиц монголоидной расы ИМТ 18,5-22,9 кг/м 2 расценивается как нормальный Значение ИМТ ≥23,0 кг/м 2 соответствует избыточной массе тела, при ИМТ ≥27,5 кг/м 2 диагностируется ожирение (УДД 1, УУР А).
1.8. Для лиц монголоидной расы с целью оценки риска развития осложнений, связанных с ожирением, рекомендуется использовать классификацию ожирения по ИМТ (ВОЗ, 1997 с дополнениями): ожирение 1-й степени при ИМТ ≥27,5 кг/м 2 , ожирение 2-й степени при ИМТ ≥32,5 кг/м 2 и ожирение 3-й степени при ИМТ ≥37,5 кг/м 2 (УДД 1, УУР А) (табл. 1).
1.9. У женщин монголоидной расы абдоминальное ожирение и наличие кардиометаболического риска следует устанавливать при значении ОТ ≥80 см, у мужчин монголоидной расы абдоминальному ожирению и повышенному риску сердечно-сосудистых событий соответствует ОТ ≥90 см (УДД 2, УУР В).
Комментарии. В Российской Федерации доля населения, относящего к различным типам монголоидной расы и к смешанным формам между монголоидной и европеоидной расой, составляет около 9%. Если в европейской части территории России подавляющая часть населения относится к европеоидной расе, то в азиатской части страны доля представителей монголоидной расы значительно возрастает.
В последнее время отмечается устойчивая тенденция к увеличению распространенности ожирения в странах с азиатским населением, что обусловлено несбалансированностью питания и низкой физической активностью. Ожирение в азиатских популяциях имеет свои особенности: более высокий уровень жира в организме и меньшую массу скелетных мышц при том же или более низком значении ИМТ по сравнению с европеоидами, что послужило основанием для выделения особого фенотипа, сочетающего высокий уровень жира в организме, нормальный ИМТ и низкую мышечную массу. При этом отмечается избыточное накопление жира в брюшной полости и печени (неалкогольная жировая болезнь печени), что тесно связано с кардиометаболическим риском и ухудшением прогноза по заболеваемости и смертности [16-23].
Под кардиометаболическим риском понимают повышенную склонность к сердечно-сосудистым событиям, включая инсульт, инфаркт миокарда и заболевания периферических артерий, а также к обменным нарушениям, таким как сахарный диабет 2 типа, что продемонстрировано и в азиатских популяциях. По сути, концепция кардиометаболического риска акцентирует прогностическую роль метаболического синдрома.
Именно более высокий кардиометаболический риск у лиц азиатских популяций потребовал изменения критериев диагностики избыточной массы тела и ожирения, отличных от неазиатского населения [18-23]. Известно, что прогностическое значение ОТ в отношении наличия метаболического синдрома выше, чем значение ИМТ. Однако ОТ не включает измерение роста и, следовательно, может иметь ограничения в прогнозировании факторов риска ССЗ для высоких и низкорослых групп населения.
В ходе исследований азиатских популяций отмечалось, что ОТ имеет существенную вариабельность и ряд ограничений. В качестве альтернативы было предложено измерение окружности шеи (ОШ) как простой и надежной антропометрический маркер [24]. Сделаны попытки определить половые количественные показатели ОШ на основании перекрестного обсервационного исследования в Бангладеш с высокой корреляцией с содержанием висцерального жира [25].
В то же время, хотя ИМТ отражает содержание как мышечной, так и жировой массы тела, но имеет важные преимущества: ИМТ легко измерить, что существенно в учреждениях первичной медицинской помощи. Среди разных этнических групп в Азии процентное содержание жира в организме при равном ИМТ может варьировать. Однако в целом у азиатов кардиометаболический риск выше, чем у неазиатской популяции в одинаковом диапазоне ИМТ. Поэтому именно этот антропометрический индекс используют для диагностики избыточной массы тела/ожирения в азиатских популяциях [18, 19].
Общепринято, что пороговые значения ИМТ для определения избыточного веса и ожирения должны быть ниже для азиатов. Эти критерии обсуждаются, и в разных странах с различными этническими особенностями азиатских популяций могут отличаться. В 2019 г. ADA (American Diabetes Association) в стандартах медицинской помощи в лечении сахарного диабета в разделе «Ведение ожирения» дают отрезные точки ИМТ, разработанные для азиатских популяций американцев [26]. На территории Российской Федерации проживают представители различных азиатских этносов (буряты, якуты и др.), в связи с чем встает вопрос о том, какую классификацию применить.
Кроме того, в этих же регионах для диагностики абдоминального ожирения и оценки риска заболеваний, связанных с ним, некоторыми авторами предложено использовать региональные и этнические значения пороговых значений ОТ: для мужчин от 85 см и для женщин от 74 до 80 см.
ДИАГНОСТИКА ОСЛОЖНЕНИЙ ОЖИРЕНИЯ
1.10. На втором этапе обследования всем лицам с ожирением, подтвержденным антропометрическими критериями, рекомендуется проводить диагностику осложнений, ассоциированных с избыточным содержанием жировой ткани в организме (УДД 2, УУР В).
1.11. У лиц с ожирением в рутинной клинической практике рекомендуется определение клинических и биохимических параметров, являющихся факторами риска развития сахарного диабета и сердечно-сосудистых заболеваний (УДД 3, УУР С).
Комментарии. К факторам сердечно-сосудистого риска относятся: артериальная гипертензия (АГ) (АД ≥ 130/85 мм рт.ст.), повышение уровня триглицеридов (ТГ) ( ≥ 1,7 ммоль/л), снижение уровня холестерина липопротеидов высокой плотности (ХС ЛПВП) (3,0 ммоль/л), гипергликемия натощак (глюкоза в плазме крови натощак ≥ 6,1 ммоль/л), нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 ч после нагрузки глюкозой в пределах ≥ 7,8 и ≤11,1 ммоль/л).
1.12. Для диагностики нарушений углеводного обмена (предиабет, сахарный диабет 2 типа) в качестве скрининга всем пациентам с ожирением рекомендовано определить глюкозу плазмы натощак (УДД 3, УУР С), или провести тест толерантности к глюкозе (УДД 1, УУР 1), и/или определить уровень гликиро-ванного гемоглобина (HbA1c) (УДД 5, УУР С).
Комментарии. При наличии ожирения и других факторов риска следует провести исследование глюкозы плазмы натощак, тест толерантности к глюкозе и/или определить уровень гликированного гемоглобина [27, 28]. Определение базального и стимулированного иммунореактивного инсулина в рутинной клинической практике не рекомендуется в связи с высокой вариабельностью и низкой информативностью. Согласно «Алгоритмам специализированной медицинской помощи больным сахарным диабетом» 2019 г., для диагностики нарушений углеводного обмена следует использовать критерии ВОЗ, представленные в главе 3 [29].
1.13. Для диагностики нарушений липидного обмена всем пациентам с ожирением рекомендуется определение липидного профиля, включая общий холестерин, ТГ, ЛПВП, ЛПНП (УДД 1, УУР А).
Комментарии. Для диагностики нарушений липидного обмена у лиц с ожирением следует использовать диагностические критерии, рекомендованные ВОЗ, Европейским обществом кардиологов (ЕОК) и Европейским обществом атеросклероза (ЕОА) по диагностике и лечению дислипидемий, представленные в главе 8.
1.14. Для диагностики артериальной гипертензии у всех пациентов с ожирением в качестве скрининга рекомендовано измерение артериального давления (УДД 1, УУР А).
Комментарии. При уровне АД ≥ 135/85 мм рт.ст. для дополнительного обследования следует провести суточное мониторирование АД [30]. Измерение АД проводит врач или медсестра в амбулаторных условиях или в стационаре.Соблюдение правил измерения АД необходимо для точной диагностики артериальной гипертензии и определения
степени тяжести.
Правила измерения АД: выполняется в положении исследуемого сидя в удобной позе, рука на столе, находится на уровне сердца, манжета накладывается на плечо, нижний край ее на 2 см выше локтевого сгиба.
Условия измерения АД: исключается употребление кофе и крепкого чая в течение 1 ч перед исследованием, рекомендуется не курить в течение 30 мин до измерения АД, отменяется прием симпатомиметиков, включая назальные и глазные капли. АД измеряется в покое после 5-минутного отдыха, в случае если процедуре измерения АД предшествовала значительная физическая или эмоциональная нагрузка, период отдыха следует продлить до 15–30 мин.
Оснащение для измерения АД: размер манжеты должен соответствовать размеру руки: резиновая раздуваемая часть манжеты должна охватывать не менее 80% окружности плеча, для плеча окружностью 27–34 см — манжета 13 × 30 см, для плеча окружностью 35–44 см — манжета 16 × 38 см, для плеча окружностью 45–52 см — манжета 20 × 42 см. Таким образом, для многих пациентов, страдающих ожирением, манжеты стандартного размера могут быть недостаточными для получения достоверных результатов измерения АД. Столбик ртути или стрелка тонометра перед началом измерения должны находиться на нулевой отметке [31].
Для диагностики артериальной гипертензии у лиц с ожирением следует использовать критерии, представленные в главе 7, согласно Клиническим рекомендациям по диагностике и лечению артериальной гипертонии у взрослых Российского кардиологического общества и Российского медицинского общества по артериальной гипертонии.
1.15. Для диагностики неалкогольной жировой болезни печени (НАЖБП) всем пациентам с ожирением рекомендуется проведение ультразвукового исследования печени и определение уровня аланинаминотрансферазы (АлАТ), аспаргинаминотрансферазы (АсАТ) и гамма-глутамилтранcпептидазы (ГГТ) (УДД 2, УУР В).
Комментарии. Для диагностики НАЖБП у лиц с ожирением следует использовать критерии, рекомендованные Российским обществом по изучению печени и Российской гастроэнтерологической ассоциацией, представленные в главе 10.
1.16. Для диагностики гиперурикемии всем пациентам с ожирением рекомендуется исследование уровня мочевой кислоты в сыворотке крови (УДД 2, УУР В).
Подробные рекомендации по диагностике и лечению нарушений обмена мочевой кислоты представлены в главе 14.
1.17. Все пациентки с ожирением и нарушениями менструального цикла, бесплодием или симптомами гиперандрогении (акне, гирсутизм или андрогенная алопеция) должны быть обследованы для исключения синдрома поликистозных яичников (СПКЯ) (УДД 2, УУР В).
Комментарии. Диагностика синдрома поликистозных яичников основана на регистрации клинических и лабораторных проявлений гиперандрогении, оценке менструальной, овуляторной функции, а также морфологии яичников с помощью ультрасонографии. У женщин с ожирением наличие СПКЯ должно быть установлено в соответствии с Роттердамским консенсусом, который требует наличия двух из трех критериев, включая гиперандрогению, хроническую ановуляцию и поликистоз яичников, которые оцениваются с помощью ультразвукового исследования [32]. В соответствии с согласованными критериями ASRM/ESHRE, принятыми в Роттердаме (2003), для диагностики поликистозных яичников при ультрасонографии необходимо наличие в яичнике 12 и более фолликулов, имеющих диаметр 2–9 мм, и/или увеличение овариального объема более 10 мл. Увеличение овариального объема считается более надежным критерием диагностики СПКЯ, чем количество фолликулов.
1.18. У всех пациентов с ожирением рекомендуется выявлять симптомы, характерные для обструктивного апноэ сна (ОАС), и при их наличии для скрининга синдрома ОАС рекомендуется проведение ночной пульсоксиметрии в качестве неинвазивного метода измерения процентного содержания оксигемоглобина в артериальной крови (SpO2) (УДД 3, УУР С).
Комментарии. При выявлении комплекса ОАС, циклически повторяющихся эпизодов значительного снижения сатурации крови кислородом более чем на 4% от базальной по данным пульсоксиметрии показано проведение полисомнографического исследования. Пациенты с диагностированным ОАС направляются в специализированное лечебное учреждение [33].
1.19. Все пациенты с ожирением должны быть обследованы путем опроса и физикального осмотра с целью диагностики остеоартрита и остеоартроза коленного и других крупных суставов (УДД 3, УУР С).
1.20. Пациенты с ожирением и симптомами гастроэзофагеальной рефлюксной болезни должны быть обследованы путем проведения эзофагогастродуоденоскопии (УДД 3, УУР С).
1.21. При выявлении симптомов депрессии пациенты с ожирением должны направляться на консультацию психиатра (УДД 3, УУР С).
Рекомендации по диагностике и лечению психосоматических расстройств у пациентов с ожирением в клинической практике представлены в главе 14.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ОЖИРЕНИЯ
На третьем этапе для постановки диагноза «Ожирение, обусловленное избыточным поступлением энергетических ресурсов» (код по МКБ-10 Е66.0), или первичное ожирение, следует провести дифференциальную диагностику с целью исключения или подтверждения вторичного ожирения, вызванного эндокринной или синдромальной патологией.
1.22. Всем пациентам с ожирением рекомендуется определение уровня тиреотропного гормона (TТГ) в сыворотке крови для диагностики гипотиреоза с использованием тех же референсных значений уровня ТТГ, что и для лиц с нормальной массой тела (УДД 3, УУР С).
Комментарии. Распространенность гипотиреоза среди лиц с ожирением, по данным метаанализа 19 исследований, составляет 14% (95% доверительный интервал (ДИ) 9,7–18,9) [34, 35]. Некомпенсированный гипотиреоз может способствовать увеличению массы тела и развитию осложнений у лиц ожирением, а также снижать эффективность мероприятий, направленных на снижение массы тела. Диагностику гипотиреоза у пациентов с ожирением следует проводить согласно критериям диагностики, представленным в клинических рекомендациях Российской ассоциации эндокринологов.
1.23. Пациентам с ожирением, имеющим характерные клинические проявления (остеопороз, низкотравматичные переломы, спонтанные экхимозы, истончение кожи, наличие багровых стрий), рекомендуется обследование для исключения эндогенного гиперкортицизма (УДД 3, УУР С).
Комментарии. Частота эндогенного гиперкортицизма среди больных ожирением составляет около 1% (0,9%, 95% ДИ 0,3–1,6) [36–38]. Принимая во внимание высокую распространенность ожирения, его многофакторную этиологию и низкую распространенность эндогенного гиперкортицизма, в настоящее время в рутинной клинической практике не рекомендуется проведение скрининга на эндогенный гиперкортицизм у всех пациентов с ожирением. Следовательно, скрининг для исключения гиперкортицизма следует проводить у пациентов, у которых, помимо ожирения, проявляются другие специфические симптомы гиперкортицизма.
Обследование для исключения эндогенного гиперкортицизма рекомендовано в следующих группах пациентов [36–42]: молодые люди с необычными для их возраста проявлениями (например, остеопороз с низкотравматическими переломами, сахарный диабет и ожирение, артериальная гипертензия, аменорея у женщин и снижение полового влечения у мужчин, быстрая прибавка массы тела в сочетании с выраженной общей и мышечной слабостью), пациенты с характерными изменениями внешности и множеством разнообразных клинических проявлений гиперкортицизма, пациенты со случайно выявленным новообразованием надпочечника, пациенты любого возраста с плохо контролируемым сахарным диабетом и/или гипертензией в сочетании с ожирением или быстрой прибавкой массы тела, пациенты с переломами тел позвонков, особенно множественными переломами в возрасте до 65 лет.
1.24. Всем пациентам, являющимся кандидатами на бариатрические операции, рекомендовано исключение эндогенного гиперкортицизма (УДД 3, УУР С).
Комментарии. Несмотря на то что гиперкортицизм является достаточно редким заболеванием, в случае хирургического лечения ожирения данное состояние может стать причиной серьезных осложнений. Такие клинические черты, присущие гиперкортицизму, как гиперкоагуляция и высокий риск ССЗ, могут стать причиной серьезных осложнений как в раннем, так и позднем послеоперационном периоде [43, 44].
Ночной подавляющий тест с 1 мг дексаметазона может рассматриваться как тест первой линии. Риск ложноположительных результатов при морбидном ожирении несколько повышается, однако специфичность теста остается высокой и составляет 92%. Недавние исследования показали, что увеличение дозы дексаметазона до 2 мг при ожирении не повышает чувствительности теста. При неадекватном подавлении уровня кортизола в ходе ночного подавляющего теста требуется проведение второго теста: определение кортизола слюны вечером или определение кортизола суточной мочи [45].
1.25. У мужчин с ожирением при наличии характерных жалоб и клинических проявлений гипогонадизма рекомендуется определение общего тестостерона, секс-стероидсвязывающего глобулина, расчет свободного тестостерона, исследование лютеинизирующего (ЛГ) и фолликулостимулирующего гормонов (ФСГ) (УДД 2, УУР В).
Комментарии. При диагностике гипогонадизма в рутинной клинической практике следует ориентироваться на три основных признака: снижение либидо и сексуальной активности, снижение числа утренних эрекций, снижение адекватных эрекций [46]. При диагностике гипогонадизма у лиц с ожирением следует использовать критерии, представленные в главе 6.
1.26. Исследование уровня пролактина при ожирении рекомендуется проводить у женщин с нарушениями менструального цикла, бесплодием и при наличии лактореи, а также у мужчин с гипогонадизмом, подтвержденным данными лабораторных исследований (УДД 3, УУР С).
Комментарии. Вне зависимости от причины гиперпролактинемии, избыточная секреция пролактина приводит к нарушениям пульсаторного выброса ЛГ, ФСГ и, как следствие, к гипогонадизму и бесплодию [47]. Со стороны репродуктивной системы наблюдаются галакторея, нарушения менструального цикла (аменорея, олиго/опсоменорея, ановуляторные циклы, недостаточность лютеиновой фазы), бесплодие, снижение полового влечения, фригидность. У мужчин проявлениями гиперпролактинемии могут быть снижение или отсутствие либидо и потенции, уменьшение вторичных половых признаков, бесплодие вследствие олигоспермии, гинекомастия. Пациентов с макропролактиномами могут беспокоить жалобы, связанные с наличием объемного образования, — головная боль, повышение внутричерепного давления, сужение полей зрения. Основным диагностическим критерием гиперпролактинемии служит определение уровня пролактина в сыворотке крови. Сложность интерпретации показателей базального уровня пролактина обусловлена не только транзиторным повышением гормона при стрессах или чрезмерных физических нагрузках, но и существенной вариабельностью показателей у одного и того же больного при соблюдении всех рекомендаций по сбору крови. Большинство российских экспертов придерживаются мнения о необходимости как минимум двукратного проведения лабораторного анализа. Как правило, микроаденомы ассоциированы с уровнем более 5000 мЕд/л (250 мг/л), макроаденомы — более 10 000 мЕд/л (500 мг/л), при этом уровень пролактина менее 2000 мЕд/л (100 мг/л) более характерен для гиперпролактинемии неопухолевого генеза [47].
1.27. Пациентам с ожирением, прогрессирующим увеличением массы тела и клиническими признаками гипогликемических состояний рекомендуется проведение обследования для исключения органического гиперинсулинизма (УДД 3, УУР С).
Комментарии. Триада Уиппла остается фундаментом диагностики органического гиперинсулинизма. Триада представлена симптомами гипогликемии, снижением уровня глюкозы в плазме, исчезновением симптомов гипогликемии после введения глюкозы [48]. Общепринято, что диагноз инсулиномы должен быть лабораторно подтвержден, для чего используются следующие 6 критериев: документированное снижение уровня глюкозы в плазме ≤2,5 ммоль/л, сопутствующий гипогликемии уровень инсулина ≥3,0 мкЕД/мл, уровень C-пептида ≥0,6 нг/мл, уровень проинсулина ≥5,0 пмоль/л, уровень β-гидроксибутирата ≤2,7 ммоль/л, отсутствие субстанций сахароснижающих препаратов в плазме и/или моче. При отсутствии возможности забора крови на фоне спонтанной гипогликемии проводится тест с голоданием, длительность которого может достигать 72 ч [48].
1.28. Пациентам с ожирением, манифестировавшим в детском возрасте, и имеющим фенотипические особенности рекомендуется провести диагностику для исключения несиндромального моногенного ожирения и синдромальных форм ожирения (УДД 3, УУР С).
Комментарии. Моногенные формы ожирения обусловлены мутациями одного гена с высокой пенетрантностью. К моногенным формам ожирения относят: мутации гена лептина, гена рецептора лептина, гена прогормона конвертазы 1, гена проопиомеланокортина, гена рецептора меланокортина-4, гена рецептора нейротропной тирозиновой киназы 2-го типа. Следует отметить, что моногенные формы ожирения встречаются крайне редко [49].
Синдромальные формы ожирения наблюдаются при хромосомных и других генетических синдромах и отличаются широким клиническим полиморфизмом. При подозрении на синдромальное или моногенное ожирение рекомендуется проведение молекулярно-генетического или цитогенетического исследования [49].
Синдром Прадера–Вилли: самый часто встречаемый вариант синдромального ожирения. Характерны мышечная гипотония при рождении, задержка нервно-психического развития, прогрессирующее ожирение со 2-го года жизни, гипогонадизм, низкорослость, отставание в умственном развитии, косоглазие, сколиоз.
ROHHAD-синдром: редкий синдром, основными компонентами которого являются ожирение в сочетании с гипоталамической дисфункцией, гиповентиляцией и дисрегуляцией автономной нервной системы.
Синдром Альстрёма: ожирение с детского возраста, дислипидемия, низкий рост, дилатационная кардиомиопатия, сахарный диабет, нистагм, светобоязнь, нейросенсорная тугоухость, задержка умственного развития, уронефрологические нарушения, бесплодие.
Синдром Барде–Бидля: ожирение с первого года жизни, пигментный ретинит, низкий рост, задержка умственного развития, полидактилия, синдактилия, врожденный порок сердца, нефрогенный несахарный диабет.
Синдром Коэна: основными признаками являются мышечная гипотония, умственная отсталость и ожирение. Характерны микроцефалия, большие уши, гипоплазия верней челюсти.
Синдром Карпентера: акроцефалия (высокий башенный череп), краниосиностоз и ожирение, синдактилия II–V пальцев рук, полидактилия и синдактилия пальцев ног, увеличение нижней челюсти, пороки сердца, умеренная умственная отсталость.
СПИСОК ЛИТЕРАТУРЫ | REFERENCES
1. Must A. The Disease Burden Associated With Overweight and Obesity. JAMA. 1999,282(16):1523. doi: https://doi.org/10.1001/jama.282.16.1523
2. Guh DP, Zhang W, Bansback N, Amarsi Z, Birmingham CL, Anis AH. The incidence of co-morbidities related to obesity and overweight: A systematic review and meta-analysis. BMC Public Health. 2009,9(1):88. doi: https://doi.org/10.1186/1471-2458-9-88
3. Lenz M, Richter T, Mühlhauser I. The Morbidity and Mortality Associated With Overweight and Obesity in Adulthood. Dtsch Aerzteblatt Online. 2009,106:641-648. doi: https://doi.org/10.3238/arztebl.2009.0641
4. Physical status: the use and interpretation of anthropometry. Report of a WHO Expert Committee. World Health Organ Tech Rep Ser. 1995. doi: https://doi.org/10.1002/(sici)1520-6300(1996)8:63.0.co,2-i
5. Forbes GB, Reina JC. Adult lean body mass declines with age: Some longitudinal observations. Metabolism. 1970,19(9):653-663. doi: https://doi.org/10.1016/0026-0495(70)90062-4
6. Rolland-Cachera MF et al. Body mass index variations — centiles from birth to 87 years. European Journal of Clinical Nutrition. 1991,45:13-21.
7. Ross R, Shaw KD, Rissanen J, et al. Sex differences in lean and adipose tissue distribution by magnetic resonance imaging: anthropometric relationships. Am J Clin Nutr. 1994,59(6):1277-1285. doi: https://doi.org/10.1093/ajcn/59.6.1277
8. Shen W, Wang Z, Punyanita M, et al. Adipose Tissue Quantification by Imaging Methods: A Proposed Classification. Obes Res. 2003,11(1):5-16. doi: https://doi.org/10.1038/oby.2003.3
9. Alberti KGMM, Zimmet P, Shaw J. The metabolic syndrome—a new worldwide definition. Lancet. 2005,366(9491):1059-1062. doi: https://doi.org/10.1016/S0140-6736(05)67402-8
11. Lean MEJ, Han TS, Morrison CE. Waist circumference as a measure for indicating need for weight management. BMJ. 1995,311(6998):158-161. doi: https://doi.org/10.1136/bmj.311.6998.158
12. Han TS et al. Waist circumference relates to intra-abdominal fat mass better than waist:hip ratio in women. Proceedings of the Nutrition Society. 1995,54:152A.
13. Pouliot M-C, Després J-P, Lemieux S, et al. Waist circumference and abdominal sagittal diameter: Best simple anthropometric indexes of abdominal visceral adipose tissue accumulation and related cardiovascular risk in men and women. Am J Cardiol. 1994,73(7):460-468. doi: https://doi.org/10.1016/0002-9149(94)90676-9
14. Wormser D, et al. Separate and combined associations of body-mass index and abdominal adiposity with cardiovascular disease: collaborative analysis of 58 prospective studies. Lancet. 2011,377(9771):1085–1095. doi: https://doi.org/10.1016/S0140-6736(11)60105-0
15. Fox CS, Massaro JM, Hoffmann U, et al. Abdominal Visceral and Subcutaneous Adipose Tissue Compartments. Circulation. 2007,116(1):39-48. doi: https://doi.org/10.1161/CIRCULATIONAHA.106.675355
16. Misra A, Jayawardena R, Anoop S. Obesity in South Asia: Phenotype, Morbidities, and Mitigation. Curr Obes Rep. 2019,8(1):43-52. doi: https://doi.org/10.1007/s13679-019-0328-0
17. Cheng L, Yan W, Zhu L, et al. Comparative analysis of IDF, ATPIII and CDS in the diagnosis of metabolic syndrome among adult inhabitants in Jiangxi Province, China. PLoS One. 2017,12(12):e0189046. doi: https://doi.org/10.1371/journal.pone.0189046
18. Nishida C, Barba C, Cavalli-Sforza T, et al. Appropriate bodymass index for Asian populations and its implications for policy and intervention strategies. Lancet. 2004,363(9403):157-163. doi: https://doi.org/10.1016/S0140-6736(03)15268-3
19. Pan W-H, Yeh W-T. How to define obesity? Evidence-based multiple action points for public awareness, screening, and treatment: an extension of Asian-Pacific recommendations. Asia Pac J Clin Nutr. 2008. doi: https://doi.org/10.6133/apjcn.2008.17.3.02
20. Nam GE, Park HS. Perspective on Diagnostic Criteria for Obesity and Abdominal Obesity in Korean Adults. J Obes Metab Syndr. 2018,27(3):134-142. doi: https://doi.org/10.7570/jomes.2018.27.3.134
21. Zeng Q, He Y, Dong S, et al. Optimal cut-off values of BMI, waist circumference and waist:height ratio for defining obesity in Chinese adults. Br J Nutr. 2014,112(10):1735-1744. doi: https://doi.org/10.1017/S0007114514002657
22. Jih J, Mukherjea A, Vittinghoff E, et al. Using appropriate body mass index cut points for overweight and obesity among Asian Americans. Prev Med (Baltim). 2014,65:1-6. doi: https://doi.org/10.1016/j.ypmed.2014.04.010
23. Garvey WT, Mechanick JI, Brett EM, et al. Reviewers of the AACE/ACE Obesity Clinical Practice Guidelines. American association of clinical endocrinologists and American college of endocrinology comprehensive clinical practice guidelines for medical care of patients with obesity. EndocrPract. 2016,22(3):1-203. doi: https://doi.org/10.4158/EP161365
24. Anothaisintawee T, Sansanayudh N, Thamakaison S, et al. Neck Circumference as an Anthropometric Indicator of Central Obesity in Patients with Prediabetes: A Cross-Sectional Study. Biomed Res Int. 2019,2019:1-8. doi: https://doi.org/10.1155/2019/4808541
25. Qureshi N, Hossain T, Hassan M, et al. Neck circumference as a marker of overweight and obesity and cutoff values for Bangladeshi adults. Indian J Endocrinol Metab. 2017,21(6):803. doi: https://doi.org/10.4103/ijem.IJEM_196_17
26. ADA. Standarts of medical care in diabetes-2019. Diabetes Care. 2019,24(1):s1-s187.
27. WHO. Definition and Diagnosis of Diabetes Mellitus and Intermediate Hyperglycemia: Report of a WHO/IDF Consultation, 2006.
28. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом: Клинические рекомендации (Вып. 9) // Сахарный диабет. — 2019. — Т. 22. — №S1. — С. 1-144. [Dedov II, Shestakova MV, Mayorov AYu, et al. Standards of specialized diabetes care. Diabetes Mellitus. 2019,22(S1):1-144 (In Russ.)]. doi: https://doi.org/10.14341/DM221S1
29. Piepoli MF, Hoes AW, Agewall S, et al. ESC Scientific Document Group. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts) Developed with the special contribution of the European. Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J. 2016,37:2315-2381.
30. Российское медицинское общество по артериальной гипертонии. Рекомендации по ведению больных артериальной гипертонией с метаболическими нарушениями и сахарным диабетом 2-го типа // Системные гипертензии. — 2020. — Т. 17. — №1. — С. 7-45. [Chazova IE, Shestakova MV, Zhernakova YV, et al. Guidelines on treatment of patients with arterial hypertension comorbid with metabolic disorders and diabetes mellitus type 2. Syst Hypertens. 2020,17(1):7-45. (In Russ.)]. doi: https://doi.org/10.26442/2075082X.2020.1.200051
31. Chazova IE, Shestakova MV, Zhernakova YV, et al. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod. 2004,19(1):41-47. doi: https://doi.org/10.1093/humrep/deh098
32. Kapur VK, Auckley DH, Chowdhuri S, et al. Clinical Practice Guideline for Diagnostic Testing for Adult Obstructive Sleep Apnea: An American Academy of Sleep Medicine Clinical Practice Guideline. J Clin Sleep Med. 2017,13(03):479-504. doi: https://doi.org/10.5664/jcsm.6506
33. Garmendia Madariaga A, Santos Palacios S, Guillén-Grima F, Galofré JC. The Incidence and Prevalence of Thyroid Dysfunction in Europe: A Meta-Analysis. J Clin Endocrinol Metab. 2014,99(3):923-931. doi: https://doi.org/10.1210/jc.2013-2409
34. Michalaki MA, Vagenakis AG, Leonardou AS, et al. Thyroid Function in Humans with Morbid Obesity. Thyroid. 2006,16(1):73-78. doi: https://doi.org/10.1089/thy.2006.16.73
35. Tiryakioglu O, Ugurlu S, Yalin S, et al. Screening for Cushing’s syndrome in obese patients. Clinics. 2010,65(1):9-13. doi: https://doi.org/10.1590/S1807-59322010000100003
36. Lammert A, Nittka S, Otto M, et al. Performance of the 1 mg dexamethasone suppression test in patients with severe obesity. Obesity. 2016,24(4):850-855. doi: https://doi.org/10.1002/oby.21442
37. Janković D, Wolf P, Anderwald C-H, et al. Prevalence of Endocrine Disorders in Morbidly Obese Patients and the Effects of Bariatric Surgery on Endocrine and Metabolic Parameters. Obes Surg. 2012,22(1):62-69. doi: https://doi.org/10.1007/s11695-011-0545-4
38. Catargi B, Rigalleau V, Poussin A, et al. Occult Cushing’s Syndrome in Type-2 Diabetes. J Clin Endocrinol Metab. 2003,88(12):5808-5813. doi: https://doi.org/10.1210/jc.2003-030254
39. Leibowitz G, Tsur A, Chayen SD, et al. Pre-clinical Cushing’s syndrome: an unexpected frequent cause of poor glycaemic control in obese diabetic patients. Clin Endocrinol (Oxf). 1996,44(6):717-722. doi: https://doi.org/10.1046/j.1365-2265.1996.737558.x
40. Steffensen C, Pereira AM, Dekkers OM, Jørgensen JOL. Diagnosis of endocrine disease: Prevalence of hypercortisolism in type 2 diabetes patients: a systematic review and meta-analysis. Eur J Endocrinol. 2016,175(6):R247-R253. doi: https://doi.org/10.1530/EJE-16-0434
41. Caetano MSS, Silva RDC, Kater CE. Increased diagnostic probability of subclinical cushing’s syndrome in a population sample of overweight adult patients with type 2 diabetes mellitus. Arq Bras Endocrinol Metabol. 2007,51(7):1118-1127. doi: https://doi.org/10.1590/S0004-27302007000700015
42. Fleseriu M, Ludlam WH, Teh SH, Yedinak CG, Deveney C, Sheppard BC. Cushing’s syndrome might be underappreciated in patients seeking bariatric surgery: a plea for screening. Surg Obes Relat Dis. 2009,5(1):116-119. doi: https://doi.org/10.1016/j.soard.2008.09.011
43. Savastano S, Pivonello R, Colao A. Bariatric surgery for obesity and hidden Cushing syndrome. Surg Obes Relat Dis. 2009,5(1):121-122. doi: https://doi.org/10.1016/j.soard.2008.07.006
44. Loriaux DL. Diagnosis and Differential Diagnosis of Cushing’s Syndrome. N Engl J Med. 2017,376(15):1451-1459. doi: https://doi.org/10.1056/NEJMra1505550
45. Dhindsa S, Ghanim H, Batra M, Dandona P. Hypogonadotropic Hypogonadism in Men With Diabesity. Diabetes Care. 2018,41(7):1516-1525. doi: https://doi.org/10.2337/dc17-2510
46. Auriemma RS, De Alcubierre D, Pirchio R, et al. The effects of hyperprolactinemia and its control on metabolic diseases. Expert Rev Endocrinol Metab. 2018,13(2):99-106. doi: https://doi.org/10.1080/17446651.2018.1434412
47. Evaluation and Management of Adult Hypoglycemic Disorders: An Endocrine Society Clinical Practice Guideline. Journal of Clinical Endocrinology & Metabolism. 2009,94(3):709-728.
48. van der Klaauw AA, Farooqi IS. The Hunger Genes: Pathways to Obesity. Cell. 2015,161(1):119-132. doi: https://doi.org/10.1016/j.cell.2015.03.008
49. Koves IH, Roth C. Genetic and Syndromic Causes of Obesity and its Management. Indian J Pediatr. 2018,85(6):478-485. doi: https://doi.org/10.1007/s12098-017-2502-2
ГЛАВА 2. ЛЕЧЕНИЕ НЕОСЛОЖНЕННОГО ОЖИРЕНИЯ
2.1. ОСНОВНЫЕ ПРИНЦИПЫ ЛЕЧЕНИЯ
Ершова Е.В., Комшилова К.А.
Снижение массы тела показано всем пациентам, имеющим ожирение, а также пациентам с избыточной массой тела и наличием одного и более факторов риска ССЗ или с наличием сопутствующих заболеваний, течение которых ассоциировано с ожирением. Пациентам с избыточной массой тела, у которых нет сопутствующих заболеваний, течение которых ассоциировано с ожирением, или факторов риска ССЗ, рекомендуется не допускать дальнейшего увеличения массы тела. Целями лечения ожирения являются снижение массы тела до такого уровня, при котором достигаются максимально возможное уменьшение риска для здоровья и улучшение течения заболеваний, ассоциированных с ожирением, поддержание достигнутого результата, улучшение качества жизни больных.
2.1. Рекомендуется снижение массы тела на 5–10% за 3–6 мес терапии и удержание результата в течение года, что позволяет уменьшить риски для здоровья, а также улучшить течение заболеваний, ассоциированных с ожирением. Большую (15–20% и более) потерю массы тела можно рекомендовать для пациентов с ИМТ ≥35 кг/ м 2 при наличии коморбидных заболеваний [1–7] (УДД 5, УУР С).
Комментарии. С учетом того, что ожирение является хроническим заболеванием, контроль над ним необходимо осуществлять на протяжении всей жизни под постоянным наблюдением для предотвращения восстановления потерянной массы тела, а также для мониторинга рисков коморбидных заболеваний или их лечения (например, СД2, ССЗ).
2.2. Пациентам, достигшим клинически значимого снижения массы тела (≥5% от исходной), рекомендуется удержание веса в течение 1–2 лет [2–7] (УДД 2, УУР B).
2.3. На этапе удержания массы тела рекомендуются ежемесячное консультирование со специалистом (очное или дистанционное), регулярный контроль массы тела (взвешивание не реже 1 раза в неделю), сохранение или расширение режима аэробных физических нагрузок, эукалорийное сбалансированное питание [1–14] (УДД 5, УУР C).
НЕМЕДИКАМЕНТОЗНАЯ ТЕРАПИЯ
2.4. Немедикаментозная терапия (изменение образа жизни посредством коррекции питания и расширения объема физических нагрузок в объеме, безопасном с точки зрения сердечно-сосудистой системы) является основой лечения ожирения и рекомендуется как первый, обязательный и постоянный этап лечения ожирения [1, 7–9] (УДД 2, УУР В).
2.5. Для снижения массы тела рекомендуется гипокалорийная диета (дефицит 500–700 ккал от физиологической потребности с учетом массы тела, возраста и пола), сбалансированная по пищевым ингредиентам, на этапе поддержания достигнутой массы тела — сбалансированная по пищевым ингредиентам эукалорийная диета. Голодание не рекомендуется в связи с отсутствием данных о его эффективности и безопасности в лечении ожирения в долгосрочном прогнозе [10–14] (УДД 2, УУР А).
Комментарии. Снижение калорийности питания на 500–1000 ккал в сутки от расчетного приводит к уменьшению массы тела на 0,5–1,0 кг в неделю. Такие темпы снижения массы тела сохраняются в течение 3–6 мес. В дальнейшем умеренное снижение массы тела приводит к уменьшению энергозатрат на 16 ккал/кг в сутки у мужчин и на 12 ккал/кг в сутки у женщин за счет уменьшения тощей массы, в результате чего потеря массы тела приостанавливается. Большинство различных типов диет являются равноэффективными при соблюдении принципа ограничения общей калорийности рациона. Основной предиктор успеха диеты — систематическое следование данной диете.
2.6. Рекомендуется терапевтическое обучение пациентов, направленное на изменение образа жизни, квалифицированным медицинским специалистом по структурированной программе в групповом или индивидуальном порядке [15 17] (УДД 3, УУР С).
2.7. Физическая активность рекомендуется как неотъемлемая часть лечения ожирения и поддержания достигнутой в процессе лечения массы тела. Всем лицам с избыточной массой тела и ожирением показаны регулярные аэробные физические упражнения продолжительностью не менее 150 мин в неделю [18–22] (УДД 2, УУР В).
Комментарии. Увеличение физической активности уменьшает количество висцерального жира и увеличивает мышечную массу, в то же время ослабляя вызванное потерей массы тела снижение расхода энергии в покое, снижает АД, повышает толерантность к глюкозе, чувствительность к инсулину, улучшает липидный профиль, положительно влияет на длительное поддержание массы тела. Увеличение уровня физической активности (преимущественно аэробной) ≥150 мин в неделю (что эквивалентно ≥30 мин в большинство из дней) рекомендовано на этапе снижения массы тела, более интенсивные физические нагрузки (от 200 до 300 мин в неделю) могут быть рекомендованы для удержания веса в долгосрочной перспективе. Комбинированное изменение образа жизни (изменение питания в дополнение к физическим упражнениям) приводит к более значимому снижению массы тела по сравнению с «монотерапией» (диетой или физическими нагрузками).
СПИСОК ЛИТЕРАТУРЫ | REFERENCES
1. Must A. Reduction in the Incidence of Type 2 Diabetes with Lifestyle Intervention or Metformin. N Engl J Med. 2002,346(6):393-403. doi: https://doi.org/10.1056/NEJMoa012512
2. Blundell JE, Dulloo AG, Salvador J, Frühbeck G. Beyond BMI - Phenotyping the Obesities. Obes Facts. 2014,7(5):322-328. doi: https://doi.org/10.1159/000368783
3. Schwarz P, Lindström J, Kissimova-Scarbeck K, et al. The European Perspective of Type 2 Diabetes Prevention: Diabetes in Europe - Prevention Using Lifestyle, Physical Activity and Nutritional Intervention (DE-PLAN) Project. Exp Clin Endocrinol Diabetes. 2008,116(03):167-172. doi: https://doi.org/10.1055/s-2007-992115
4. Hainer V, Toplak H, Mitrakou A. Treatment Modalities of Obesity: What fits whom? Diabetes Care. 2008,31(2):S269-S277. doi: https://doi.org/10.2337/dc08-s265.
5. Sampsel S, May J. Assessment and Management of Obesity and Comorbid Conditions. Dis Manag. 2007,10(5):252-265. doi: https://doi.org/10.1089/dis.2007.105712
6. Jensen MD, Ryan DH, Apovian CM, et al. 2013 AHA/ACC/TOS Guideline for the Management of Overweight and Obesity in Adults. J Am Coll Cardiol. 2014,63(25):2985-3023. doi: https://doi.org/10.1016/j.jacc.2013.11.004
7. World Health Organization: Obesity: Preventing and Managing the Global Epidemic. Report of a WHO Consultation (WHO Technical Report Series 894). [Internet]. Geneva: 1998. www.who.int/nutrition/publications/obesity/WHO_TRS_894/en/ (cited: 2015 November 30).
8. Cefalu WT, Bray GA, Home PD, et al. Advances in the Science, Treatment, and Prevention of the Disease of Obesity: Reflections From a Diabetes Care Editors’ Expert Forum. Diabetes Care. 2015,38(8):1567-1582. doi: https://doi.org/10.2337/dc15-1081
9. Garvey WT, Mechanick JI, Brett EM, et al. American Association of Clinical Endocrinologists and American College of Endocrinology Comprehensive Clinical Practice Guidelines Formedical Care of Patients with Obesity. Endocr Pract. 2016,22:1-203. doi: https://doi.org/10.4158/EP161365.GL
10. Shai I, Schwarzfuchs D, Henkin Y, et al. Weight Loss with a LowCarbohydrate, Mediterranean, or Low-Fat Diet. N Engl J Med. 2008,359(3):229-241. doi: https://doi.org/10.1056/NEJMoa0708681
11. Dernini S, Berry EM. Mediterranean Diet: From a Healthy Diet to a Sustainable Dietary Pattern. Front Nutr. 2015,2. doi: https://doi.org/10.3389/fnut.2015.00015
12. Estruch R, Ros E, Salas-Salvadó J, et al. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. N Engl J Med. 2018,378(25):e34. doi: https://doi.org/10.1056/NEJMoa1800389.
13. Avenell A, Brown TJ, McGee MA, et al. What are the long-term benefits of weight reducing diets in adults? A systematic review of randomized controlled trials. J Hum Nutr Diet. 2004,17(4):317-335. doi: https://doi.org/10.1111/j.1365-277X.2004.00531.x
14. Dansinger ML, Gleason JA, Griffith JL, Selker HP, Schaefer EJ. Comparison of the Atkins, Ornish, Weight Watchers, and Zone Diets for Weight Loss and Heart Disease Risk Reduction. JAMA. 2005,293(1):43. doi: https://doi.org/10.1001/jama.293.1.43
15. Sharma M. Behavioural interventions for preventing and treating obesity in adults. Obes Rev. 2007,8(5):441-449. doi: https://doi.org/10.1111/j.1467-789X.2007.00351.x
16. Lang A, Froelicher ES. Management of Overweight and Obesity in Adults: Behavioral Intervention for Long-Term Weight Loss and Maintenance. Eur J Cardiovasc Nurs. 2006,5(2):102-114. doi: https://doi.org/10.1016/j.ejcnurse.2005.11.002
17. Moffitt R, Haynes A, Mohr P. Treatment Beliefs and Preferences for Psychological Therapies for Weight Management. J Clin Psychol. 2015,71(6):584-596. doi: https://doi.org/10.1002/jclp.22157
18. Willis LH, Slentz CA, Bateman LA, et al. Effects of aerobic and/ or resistance training on body mass and fat mass in overweight or obese adults. J Appl Physiol. 2012,113(12):1831-1837. doi: https://doi.org/10.1152/japplphysiol.01370.2011
19. Geliebter A, Christopher N, Ochner CN, et al. Obesity-related hormones and metabolic risk factors: a randomized trial of diet plus either strength or aerobic training versus diet alone in overweight participants. J Diabetes Obes. 2015,1:1–7.
20. Poirier P, Després J-P. Exercise in weight management of obesity. Cardiol Clin. 2001,19(3):459-470. doi: https://doi.org/10.1016/S0733-8651(05)70229-0
21. Chin S ‐H., Kahathuduwa CN, Binks M. Physical activity and obesity: what we know and what we need to know*. Obes Rev. 2016,17(12):1226-1244. doi: https://doi.org/10.1111/obr.12460
22. K. Stephens S, J. Cobiac L, Veerman JL. Improving diet and physical activity to reduce population prevalence of overweight and obesity: An overview of current evidence. Prev Med (Baltim). 2014,62:167-178. doi: https://doi.org/10.1016/j.ypmed.2014.02.008
2.2. НЕМЕДИКАМЕНТОЗНЫЕ МЕТОДЫ ЛЕЧЕНИЯ
Дзгоева Ф.Х.
Здоровое питание играет важную роль в снижении веса. Концепция, согласно которой дисфункция жировой ткани играет основную роль в возникновении метаболических нарушений, в настоящее время является общепризнанной [1]. Таким образом, основное внимание при консультировании по вопросам питания при избыточной массе весе или ожирении уделяется снижению риска различных состояний и заболеваний, ассоциированных с ожирением.
Пищевое поведение взрослых основано на опыте из детства. Важно учитывать роль семьи, так как целый ряд факторов домашней обстановки определяют стиль питания: например, наличие определенных продуктов в домашних хозяйствах, их доступность [2].
Окружающая среда и особенно семья являются основными факторами формирования пищевого поведения. Так, моделирование здорового рациона родителями и более частое совместное семейное питание могут способствовать формированию полезных пищевых привычек среди детей и подростков. Стиль питания родителей и потребление овощей в семье также влияют на потребление фруктов и овощей среди молодежи [3]. Нерациональная практика родителей в области питания детей, такая как ограничение пищи, принуждение детей к еде или использование продуктов питания в качестве вознаграждения, могут способствовать нарушениям пищевого поведения. Кроме того, имеются данные о том, что семейные социально-экономические и демографические факторы могут способствовать ожирению у молодежи. К таким факторам относятся неполноценная семья (воспитание одним из родителей), плохие условия жизни, низкий доход семьи, низкий социальный и образовательный статус родителей.
Питание в ресторанах и фастфудах, большие порции, употребление алкоголя, ночное питание, частые перекусы между приемами пищи, добавление сахара — все это увеличивает потребление энергии и связано с избыточным весом и ожирением. С другой стороны, потребление продуктов с низкой энергетической ценностью (то есть фруктов и овощей) снижает потребление энергии, что помогает потере или поддержанию веса [4].
ОБЩИЕ РЕКОМЕНДАЦИИ ДЛЯ ЗДОРОВОГО ПИТАНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ
2.8. Рекомендуется с момента начала лечения ожирения каждый пациент должен получить инструкции по здоровому питанию и правильному планированию приема пищи у квалифицированных медицинских работников (УУР А, УДД 1).
Комментарии. Занятия по изменению поведенческих модификаций по лечению проходят по структурированной учебной программе, которая начинается с обзора продуктов питания и активности участников. Медицинский работник помогает участникам определить стратегии, позволяющие справиться с выявленными проблемами, и тем самым повысить их приверженность предписанным планам питания и мероприятий. Выполнение еженедельных домашних заданий является важным компонентом изменения образа жизни. Завершение пациентами ежедневных записей о еде является последовательным предиктором начальной потери веса [5].
2.9. Рекомендуется ежедневно вести учет продуктов питания и физической активности, чтобы помочь пациентам достичь наилучших результатов (УУР А, УДД 1).
Комментарии. Ежедневный самоконтроль питания включает в себя наблюдение и запись потребления калорий, а также других, связанных с этим, аспектов пищевого поведения (время, место, эмоции и т. д.). Самоконтроль может помочь пациентам определить неадаптивные аспекты их пищевого поведения, которые часто являются побочным продуктом целого ряда экологических стимулов. Например, с помощью самоконтроля пациент может выявить привычку к чрезмерным перекусам во время вечернего просмотра телевизора. В результате стратегия изменения поведения, направленная на формирование более здорового пищевого поведения, будет заключаться в том, чтобы исключить прием пищи перед телевизором. Для решения других поведенческих и эмоциональных проблем часто используются более когнитивные интервенционные стратегии, которые нацелены на неадекватные мысли пациента о еде и поведении в отношении еды [6].
2.10. Рекомендуется пациентам с избыточной массой тела и ожирением ограничение калорийности суточного рациона с целью снижения массы тела (УУР А, УДД 1).
Комментарии. На этапе снижения массы тела важно создание отрицательного энергетического баланса за счет соблюдения низкокалорийного рациона питания на определенный промежуток времени (создание дефицита энергии 500–1000 ккал в сутки), следует уделять внимание поддержанию плана здорового питания и рекомендовать избегать причудливых диет. Рацион с дефицитом от 500 до 700 ккал в день должен быть неотъемлемой частью любой программы, направленной на достижение общего показателя снижения веса от 0,5 до 1 кг в неделю. Такой рацион обычно начинается с 1200 ккал в день, норма 1000 ккал в день должна с осторожностью использоваться у детей, пожилых и неактивных людей. В отношении микронутриентов: например, употребление рекомендуемого количества кальция от 1000 до 1500 мг в день особенно важно для женщин, которые подвержены риску остеопороза, женщинам детородного возраста необходимо адекватное потребление фолатов в пищевых продуктах, а также фолиевой кислоты (400 мкг/день) из обогащенных пищевых продуктов и/или добавок, чтобы избежать риска дефектов нервной трубки у плода.
Для успешной коррекции избыточного веса с помощью диетотерапии до начала снижения калорийности питания пациента важно оценить его исходную энергоемкость. В случае высокой исходной калорийности (>1,5 нормы, необходимой для поддержания стабильной массы тела) рекомендуется постепенно уменьшать калорийность до рекомендуемого показателя: по 300–600 ккал в течение 3–4 нед. Минимальная суточная калорийность рациона для мужчин составляет 1500 ккал, для женщин — 1200 ккал. Рекомендуемую калорийность следует распределить на 3–4 приема пищи, основной объем приходится на первую половину дня, а на ужин — лишь 15–20% рассчитанного количества. Ужинать следует за 3–4 ч до отхода ко сну.
МЕТОДЫ ОЦЕНКИ ЭНЕРГЕТИЧЕСКОГО БАЛАНСА
Общий расход энергии (ОРЭ) определяет количеством калорий, затраченных в следующих направлениях.
1. Физическая активность: составляет примерно от 20 до 30% ОРЭ.
2. Основная потребность организма в покое: скорость метаболизма в покое составляет от 65 до 75% ОРЭ.
3. Термогенез: энергия, расходуемая организмом на переработку потребляемой пищи, составляет от 10 до 15% ОРЭ.
Измерение метаболизма в состоянии покоя (МСП) теперь также возможно и практично с помощью офисного портативного медицинского устройства. МСП можно измерить с помощью ручных мониторов потребления кислорода. Оптимальные условия тестирования бывают утром, когда пациент отдыхает. Перед тестированием пациент должен воздержаться от еды и напитков (кроме воды в течение 4 ч), не иметь физической активности в течение 4 ч, не употреблять никотин за 1 ч до теста и за 10 мин до начала теста отдохнуть. Результат теста покажет количество растрачиваемой энергии МСП, которое обычно на 10% превышает основные затраты энергии [7].
Таким образом, рекомендуется просто рассчитать общий расход энергии, используя стандартизованную формулу. Дополнительная оценка преднамеренной физической активности усредняется за неделю и добавляется для оценки общих затрат калорий в день.
Формула расчета основного обмена — самого важного и преобладающего компонента затрат энергии — такова:

При низком уровне физической активности пациента (умственная, сидячая, домашняя работа) полученный результат умножается на коэффициент 1,1, при умеренной физической активности (ходьба не менее 60 мин в день, регулярные занятия спортом 2–3 раза в неделю) — на 1,3, при высокой физической активности (тяжелая физическая работа, профессиональные занятия спортом) результат умножается на коэффициент 1,5.
Наиболее простой способ расчета калорийности для пациентов с различной физической активностью с помощью учета половой и возрастной принадлежности указан в таблице 2.
«Сидячий» означает образ жизни, который включает только легкую физическую активность, связанную с повседневной жизнью.
«Активный» — образ жизни, включающий физическую активность, эквивалентную ходьбе более 5 км в день со скоростью 5–6 км/ч, в дополнение к легкой физической активности, в обычной повседневной жизни.
Таблица 2. Диапазон калорий для отдельных лиц каждой возрастной/половой принадлежности, с различными уровнями физической активности


Дискреционная норма калорий — это оставшееся количество калорий, которое может использоваться после учета вышеперечисленных групп. Это количество лучше использовать за счет продуктов, не содержащих жира или с низким процентом жирности, без добавления сахара.
РЕКОМЕНДОВАННЫЙ ПЛАН ПИТАНИЯ
Пациентам следует потреблять не более 6−8 порций углеводов в день (одна порция = 15 г углеводов), при этом 3−4 порции должны состоять из цельнозерновых продуктов с высоким содержанием клетчатки [8]. Ежедневное потребление фруктов (особенно ягод) и овощей (особенно сырых) (≥4,5 чашки в день) увеличивает поступление клетчатки, фитонутриентов и облегчает контроль над энергоемкостью пищи. И особое внимание должно уделяться потреблению цельнозерновых продуктов вместо рафинированных, так как они в большей степени обеспечивают микроэлементами, пищевыми волокнами и помогают снизить артериальное давление (АД). План питания должен включать максимум 170 г в день животного белка с пониженным содержанием жира. Основным источником животных белков должны служить молочные продукты (2−3 порций в день), поскольку они помогают снизить вес и являются не только источником белка, но и микронутриентов (кальций). Особое внимание при формировании суточного рациона необходимо уделять растительным белкам (бобы, чечевица, орехи, брокколи, капуста, шпинат) — они обладают многими полезными свойствами, которые способны улучшить показатели липидного обмена (ЛПВП, ЛПНП) и снизить уровень АД [4]. Натуральные продукты с содержанием мононенасыщенных жиров, такие как оливковое масло в средиземноморском рационе питания, должны употребляться чаще, поскольку это тесно связано с улучшением состояния здоровья. Если пациенты сосредотачиваются на снижении углеводов, а не на снижении калорий и или жиров, это может быть успешной краткосрочной стратегией для некоторых людей. Снижение потребления углеводов более чем на 35% потребляемой энергоемкости приводит к снижению потребления энергии и связано с большей потерей веса и жира в течение первых 6 мес. Эти результаты не были значимыми через один год [9]. Использование низкоуглеводных планов питания следует контролировать у пациентов с остеопорозом, заболеваниями почек и пациентов с повышенным уровнем ХС ЛПНП [10].
План питания с низким гликемическим индексом не рекомендуется для уменьшения массы тела или поддержания веса. Тем не менее актуальны общие рекомендации: есть больше свежих фруктов и овощей и меньше обработанных пищевых продуктов, в основном крахмалов и сахара, сократить потребление продуктов с высоким гликемическим индексом. 3–4 порции нежирных молочных продуктов должны быть включены в ежедневный рацион [11].
Порционный контроль должен быть включен в комплексную программу управления весом.
Общее потребление калорий должно быть распределено в течение дня на 3–4 приема пищи/закусок, включая завтрак. Большее потребление энергии днем предпочтительнее, чем вечернее чрезмерное потребление пищи и, тем более, — ночное переедание.
2.11. Рекомендуется очень низкокалорийный рацион питания в случае необходимости интенсивного снижения массы тела пациентам с ИМТ >30 кг/м 2 , у которых есть серьезные сопутствующие заболевания, или которые потерпели неудачу в других диетологических подходах в снижении веса (УУР В, УДД 2). На это время рекомендуется постоянное наблюдение медицинского персонала за состоянием электролитного баланса, активностью печеночных трансаминаз, желчевыводящей системы и контроля, дополнительное назначение недостающих макро- и микроэлементов (УУР А, УДД 1).
2.12. Рекомендуется основные макро- и микронутриенты, клетчатка, вода должны поступать с правильно подобранными продуктами и напитками, которые являются образцом здорового питания. Макронутриенты следует рекомендовать в рамках общей энергоемкости пищи, контролируемой суточным калоражем (УУР A, УДД 1).
2.13. Рекомендуется энергоемкость пищи необходимо распределить по основным макронутриентам (белкам, жирам и углеводам) на основе актуального образца питания и метаболических целей. На долю белков животного и растительного происхождения приходится примерно 15–35% калорийности (УУР А, УДД 1), углеводов — 45–55% — 6–8 порций углеводсодержащей пищи по 15 г, половина из которых должны составлять углеводы, обогащенные пищевыми волокнами (УУР А, УДД 1), и жиров — 25–35% в основном из источников растительного происхождения для снижения риска ССЗ (УУР А, УДД 1).
Комментарии по расчету потребления макронутриентов.
При формировании рационального питания на долю углеводов следует выделять от 45 до 65% поступления энергии от суточной нормы (оптимальное потребление 50−55%), за счет ограничения легкоусвояемых углеводов или продуктов с высоким гликемическим индексом (ГИ). Независимо от состава макронутриентов, суточная норма калорий рассчитывается индивидуально, с учетом пола, возраста и антропометрических параметров [12].
В зависимости от суточной нормы белки должны обеспечивать от 15 до 35% калорий. Однако их следует рекомендовать только тем пациентам, у которых отсутствует непереносимость или аллергия на лактозу, в случае дефицита мышечной массы у пациента целесообразно на долю белков выделять максимально допустимый процент калорийности или рассчитать его, умножив показатель массы тела на коэффициент от 1,1 до 1,5 — в зависимости от индивидуальных характеристик.
Суточная норма потребления жиров должна укладываться в диапазоне 25−35% общих калорий, так как она способствует уменьшению риска развития ССЗ. В структуре потребления жиров следует рекомендовать употреблять ненасыщенные жиры, входящие в состав рыбы, жидких нерафинированных растительных масел, семян, орехов, вместо продуктов с высоким содержанием насыщенных жиров (сливочное масло и животные жиры). Еженедельно в рационе должно быть не менее 2 порций рыбы (например, лосося или скумбрии) из-за содержания большого количества эйкозапентаеновой кислоты (ЭПК) и докозагексаеновой кислоты (ДГК). Часто наибольшие трудности возникают в соблюдении нормы жиров, так как при гипокалорийном питании их допустимое количество должно быть эквивалентно скрытому содержанию жиров в низкожирных продуктах.
2.14. Рекомендуется для управления избыточной массой тела и ожирением требуется мультидисциплинарный подход к их лечению (УУР А, УДД 1). В долгосрочных программах по похудению и удержанию достигнутых результатов имеет важное значение постоянное поддержание поведенческой терапии, включающее сочетание рационального питания и адекватных физических нагрузок (УУР А, УДД 1). Доказана эффективность участия пациентов в группах по управлению массой тела (УУР В, УДД 2) и постоянного учета потребляемой пищей в виде контроля над порциями (УУР А, УДД 1) [13–19].
Комментарии: ежедневный расчет нутриентов из каждой группы при заданной калорийности представлен в таблице 3.
Таблица 3. Ежедневный расчет нутриентов из каждой группы при заданной калорийности
Уровень
калорий
1000
1200
1400
1600
1800
2000
2200
2400
2600
2800
3000
3200
Группа «фрукты» включает в себя все свежие, замороженные, консервированные, сушеные фрукты и фруктовые соки. Как правило, одна чашка фруктов или 100% фруктового сока или полчашки сухофруктов могут рассматриваться как одна чашка.
Группа «овощи» включает в себя все свежие, замороженные, консервированные, сушеные овощи и овощные соки. Как правило, одна чашка сырых или приготовленных овощей, или овощного сока, или две чашки сырой листовой зелени можно рассматривать как одну чашку из группы овощей.
Группа «зерновых» включает в себя следующие продукты: пшеницу, рис, овес, кукурузную или ячменную муку. В виде хлеба, макарон, овсянки, хлопьев для завтрака, лепешек и крупы. Как правило, 28 г могут еще и рассматриваться как один стакан готовых к употреблению хлопьев или половины чашки приготовленного риса, макаронных изделий, хлопьев. По крайней мере половина всех потребляемых зерен должны быть цельными.
Группа «мясо и бобы» в целом, 28 г, может состоять из постного мяса, птицы, рыбы, одного яйца, одной столовой ложки арахисового масла, четверти чашки приготовленных сухих бобов или 14 г орехов или семян.
Группа «молоко» включает в себя все жидкие продукты, изготовленные из молока с сохранением содержания кальция, а также творог и сыр. Пищевые продукты с низким содержанием кальция, приготовленные из молока, например, сливочный сыр, сливки и масло, не входят в группу. Большинство продуктов из этой группы должны содержать низкий процент жирности или вовсе быть обезжиренными.
Группа «масла» - все растительные жиры, такие как рапсовое, кукурузное, оливковое, соевое и подсолнечное масла. Некоторые продукты с высоким содержанием масла: орехи, оливки, авокадо, любая рыба.
СПИСОК ЛИТЕРАТУРЫ | REFERENCES
1. Bays HE, González-Campoy JM, Bray GA, et al. Pathogenic potential of adipose tissue and metabolic consequences of adipocyte hypertrophy and increased visceral adiposity. Expert Rev Cardiovasc Ther. 2008,6(3):343-368. doi: https://doi.org/10.1586/14779072.6.3.343
2. Cullen KW, Baranowski T, Owens E, Marsh T, Rittenberry L, de Moor C. Availability, Accessibility, and Preferences for Fruit, 100% Fruit Juice, and Vegetables Influence Children’s Dietary Behavior. Heal Educ Behav. 2003,30(5):615-626. doi: https://doi.org/10.1177/1090198103257254
3. Hanson NI, Neumark-Sztainer D, Eisenberg ME, et al. Associations between parental report of the home food environment and adolescent intakes of fruits, vegetables and dairy foods. Public Health Nutr. 2005,8(1):77-85. doi: https://doi.org/10.1079/PHN2005661
4. Duffey KJ, Gordon-Larsen P, Jacobs DR, et al. Differential associations of fast food and restaurant food consumption with 3-y change in body mass index: the Coronary Artery Risk Development in Young Adults Study. Am J Clin Nutr. 2007,85(1):201-208. doi: https://doi.org/10.1093/ajcn/85.1.201
5. Wing RR, Tate DF, Gorin AA, et al. A Self-Regulation Program for Maintenance of Weight Loss. N Engl J Med. 2006,355(15):1563-1571. doi: https://doi.org/10.1056/NEJMoa061883
6. Schmidt ME, Haines J, O’Brien A, et al. Systematic Review of Effective Strategies for Reducing Screen Time Among Young Children. Obesity. 2012,20(7):1338-1354. doi: https://doi.org/10.1038/oby.2011.348
7. Gonzalez-Campoy JM, Castorino K, Ebrahim A, et al. Clinical Practice Guidelines for Healthy Eating for the Prevention and Treatment of Metabolic and Endocrine Diseases in Adults: Cosponsored by the American Association of Clinical Endocrinologists/ The American College of Endocrinology and the Obesity Soci. Endocr Pract. 2013,19(15):1-82. doi: https://doi.org/10.4158/EP13155.GL
8. AACE/ACE Obesity Task Force. AACE/ACE Position Statement on the Prevention, Diagnosis, and Treatment of Obesity. Endocr Pract. 1998,4:297-350.
9. Seagle HM, Strain GW, Makris A, Reeves RS. Position of the American Dietetic Association: Weight Management. J Am Diet Assoc. 2009,109(2):330-346. doi: https://doi.org/10.1016/j.jada.2008.11.041
10. 2006 Adult Weight Management EvidenceBased Nutrition Practice Guideline. Available at: https://www.andeal.org/topic.cfm?cat=2798&auth=1.2009
11. Afshin A, Sur PJ, Fay KA, et al. Health effects of dietary risks in 195 countries, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2019,393(10184):1958-1972. doi: https://doi.org/10.1016/S0140-6736(19)30041-8
12. Yancy WS, Olsen MK, Guyton JR, Bakst RP, Westman EC. A LowCarbohydrate, Ketogenic Diet versus a Low-Fat Diet To Treat Obesity and Hyperlipidemia. Ann Intern Med. 2004,140(10):769. doi: https://doi.org/10.7326/0003-4819-140-10-200405180-00006
13. Wadden TA, West DS, Neiberg RH, et al. One-year Weight Losses in the Look AHEAD Study: Factors Associated With Success. Obesity. 2009,17(4):713-722. doi: https://doi.org/10.1038/oby.2008.637
14. Wadden TA, Butryn ML, Byrne KJ. Efficacy of Lifestyle Modification for Long-Term Weight Control. Obes Res. 2004,12(S12):151S-162S. doi: https://doi.org/10.1038/oby.2004.282
15. Gonzalez-Campoy JM, Castorino K, Ebrahim A, et al. The Diabetes Prevention Program (DPP): Description of lifestyle intervention. Diabetes Care. 2002,25(12):2165-2171. doi: https://doi.org/10.2337/diacare.25.12.2165
16. Perri MG, McAllister DA, Gange JJ, et al. Effects of four maintenance programs on the long-term management of obesity. J Consult Clin Psychol. 1988,56(4):529-534. doi: https://doi.org/10.1037/0022-006X.56.4.529
17. Sbrocco T, Nedegaard RC, Stone JM, Lewis EL. Behavioral choice treatment promotes continuing weight loss: Preliminary results of a cognitive–behavioral decision-based treatment for obesity. J Consult Clin Psychol. 1999,67(2):260-266. doi: https://doi.org/10.1037/0022-006X.67.2.260
18. The Practical Guide : Identification, Evaluation, and Treatment of Overweight and Obesity in Adults. [Bethesda, Md.] :National Institutes of Health, National Heart, Lung, and Blood Institute, NHLBI Obesity Education Initiative, North American Association for the Study of Obesity, 2000.
19. NHLBI Obesity Education Initiative Expert Panel on the Identification, Evaluation, and Treatment of Obesity in Adults (US). Clinical Guidelines on the Identification, Evaluation, and Treatment of Overweight and Obesity in Adults: The Evidence Report. Bethesda (MD): National Heart, Lung, and Blood Institute, 1998 Sep. Available from: https://www.ncbi.nlm.nih.gov/books/NBK2003/
2.3. ФАРМАКОТЕРАПИЯ ОЖИРЕНИЯ
Трошина Е.А., Ершова Е.В., Комшилова К.А.
2.15. Назначение препаратов, зарегистрированных в качестве лекарственных средств для лечения ожирения, рекомендовано пациентам, которые не могут достичь в течение 3–6 мес клинически значимого снижения массы тела на 5–10% на фоне немедикаментозных методов лечения и/или на этапе удержания достигнутого результата. При этом при наличии хотя бы одного коморбидного состояния, ассоциированного с ожирением, с целью снижения риска развития осложнений назначение фармакотерапии показано сразу на фоне немедикаментозных методов лечения [1–4] (УУР С, УДД 5).
2.16. Назначение лекарственных средств для терапии ожирения рекомендовано при ИМТ ≥30 кг/м 2 или при ИМТ ≥27 кг/м 2 при наличии коморбидных заболеваний [1–4] (УУР С, УДД 5).
2.17. Оценку эффективности лекарственной терапии ожирения рекомендуется проводить спустя 3 мес после начала лечения. Неэффективным может считаться снижение массы тела менее чем на 5% от исходной в течение 3 мес [14] (УУР С, УДД 5).
2.18. Оценку безопасности терапии рекомендуется проводить спустя 1–3 мес от момента назначения препарата и не реже чем раз в 3 мес в дальнейшем [1–4] (УУР С, УДД 5).
2.19. Лечение заболеваний, ассоциированных с ожирением, проводится в рамках соответствующих стандартов в соответствии с клиническими рекомендациями. При этом рекомендуется назначение лекарственных препаратов, не влияющих на массу тела, или лекарственных препаратов, способствующих ее снижению [1–4] (УУР С, УДД 3).
2.20. Не рекомендуется назначение пищевых добавок или биологически активных добавок в связи с отсутствием данных об их эффективности и безопасности в лечении ожирения [5–10] (УУР А, УДД 2).
Комментарии. Алгоритм ведения пациента с экзогенно-конституциональным ожирением представлен на рисунке 1. В настоящее время на территории Российской Федерации зарегистрированы следующие препараты для лечения ожирения: орлистат, сибутрамин, в том числе сибутрамин + микрокристаллическая целлюлоза (МКЦ), сибутрамин + метформин, лираглутид. Алгоритм выбора препаратов для фармакотерапии ожирения представлен в таблице 4.
2.21. Орлистат (А08АВ01) — препарат для лечения ожирения периферического действия, рекомендуется пациентам с ИМТ ≥30 кг/м 2 или ИМТ ≥27 кг/м 2 при наличии коморбидных заболеваний в дозе 120 мг 3 раза в сутки во время еды или не позже 1 ч после нее для снижения массы тела. Разрешенная максимальная длительность лечения составляет 4 года [9, 12–18] (УУР А, УДД 1).
Комментарии. Орлистат, будучи специфическим, длительно действующим ингибитором желудочно-кишечной липазы, оказывает терапевтический эффект в пределах ЖКТ и не обладает системными эффектами: препятствует расщеплению и последующему всасыванию жиров, поступающих с пищей (около 30%), создавая тем самым дефицит энергии, что приводит к снижению массы тела. Орлистат способствует также снижению гиперхолестеринемии, причем независимо от степени снижения массы тела. Если прием пищи пропускают или пища не содержит жира, то прием препарата можно пропустить. Применение орлистата у больных ожирением позволяет существенно улучшить профиль факторов риска СД2, ССЗ и других заболеваний, ассоциированных с ожирением, что может благоприятно влиять на прогноз жизни у этой категории больных. Данных, позволяющих судить о влиянии орлистата на общую смертность или смертность от ССЗ, в настоящее время нет. Важным преимуществом препарата является его периферическое действие только в пределах ЖКТ и отсутствие системных эффектов. Орлистат противопоказан при острых панкреатитах и заболеваниях, сопровождающихся диареей, синдромом хронической мальабсорбции, холестазом. Орлистат повышает вероятность образования камней в желчном пузыре, однако рациональное потребление жиров не приводит к снижению моторики желчного пузыря. С учетом механизма действия, к числу побочных эффектов препарата относятся жирный стул, маслянистые выделения из прямой кишки, императивные позывы на дефекацию, учащение дефекации и недержание кала, боли в животе, выделение газов с некоторым количеством отделяемого. Выраженность и продолжительность побочных эффектов напрямую зависят от приверженности пациентов лечению и соблюдения рекомендаций по ограничению жиров в пище. Если рекомендованы поливитамины, их следует принимать не ранее чем через 2 ч после приема орлистата или перед сном.
2.22. Сибутрамин (А08АА10)*, сибутрамин+МКЦ — препарат для лечения ожирения центрального действия, рекомендуется пациентам с ИМТ ≥30 кг/м 2 или ИМТ ≥27 кг/м 2 при наличии коморбидных заболеваний, в качестве начальной дозы сибутрамина, в т.ч. сибутрамина + МКЦ, рекомендуется 10 мг утром, ежедневно, независимо от приема пищи. Если масса тела за первый месяц лечения снизилась менее чем на 2 кг, рекомендуется увеличить дозу до 15 мг сибутрамина при условии хорошей его переносимости. Если за 3 мес приема масса тела уменьшилась менее чем на 5% исходной, лечение считается неэффективным. Разрешенная максимальная длительность лечения составляет 1 год [9, 11–13, 19–21]. При необходимости возможно возобновление терапии через 3–6 месяцев. (УУР А, УДД 1).
Комментарии. Сибутрамин, будучи ингибитором обратного захвата серотонина, норадреналина и, в меньшей степени, допамина, в синапсах ЦНС, в том числе в комбинации с МКЦ, имеет двойной механизм действия: с одной стороны, он ускоряет чувство насыщения, снижая количество потребляемой пищи, с другой — увеличивает энергозатраты организма, что в совокупности приводит к отрицательному балансу энергии. Сибутрамин обеспечивает эффективное снижение массы тела вне зависимости от пола, возраста и наличия сопутствующих заболеваний. Чем выше исходный ИМТ, тем более интенсивного снижения массы тела можно ожидать. Сибутрамин обеспечивает эффективную и устойчивую потерю массы тела, улучшает метаболические показатели: достоверно снижает уровень ТГ, ОХС, ЛПНП, увеличивает количество антиатерогенных ЛПВП, уменьшает содержание мочевой кислоты в плазме крови, снижает уровень гликированного гемоглобина.
МКЦ является энтеросорбентом, обладает сорбционными свойствами и неспецифическим дезинтоксикационным действием. Связывает и выводит продукты жизнедеятельности микроорганизмов, токсины экзогенной и эндогенной природы, аллергены, ксенобиотики, а также избыток некоторых продуктов обмена веществ и метаболитов, ответственных за развитие эндогенного токсикоза.
Лечение ожирения сибутрамином требует обязательного врачебного наблюдения. Контроль АД и пульса необходим у всех больных до начала лечения, далее с 1-го по 3-й месяц лечения — каждые 2 нед, с 4-го по 6-й месяц — ежемесячно, с 6-го по 12-й месяц — каждые 3 мес. Препарат отменяют при двукратном учащении пульса более чем на 10 ударов в минуту, повышении АД более чем на 10 мм рт.ст., а также в случае, если оно при двух повторных измерениях превышает 140/90 мм рт.ст. при ранее компенсированной АГ. Препарат не может быть назначен пациентам с неконтролируемой АГ (АД выше 145/90 мм рт.ст.), ИБС, декомпенсацией хронической сердечной недостаточности, нарушением ритма сердца, цереброваскулярными заболеваниями (инсультом, транзиторными нарушениями мозгового кровообращения), окклюзионными заболеваниями периферических артерий, в возрасте старше 65 лет, при тяжелых поражениях печени и почек, которые могут встречаться при ожирении, в случае одновременного приема или спустя менее 2 нед после отмены ингибиторов моноаминоксидазы или других препаратов, действующих на ЦНС (в т.ч. антидепрессантов), при серьезных нарушениях питания и психических заболеваниях, тиреотоксикозе, феохромоцитоме, закрытоугольной глаукоме, доброкачественной гиперплазии предстательной железы. Такие побочные действия, как тошнота, потеря аппетита, запор, сухость во рту, изменение вкуса, бессонница, головная боль, возбуждение, потливость, обычно слабо выражены, отмечаются лишь в начале лечения, имеют преходящий характер и, как правило, не требуют отмены терапии.
2.23. Сибутрамин (А08АА10) в комбинации с метформином (А10ВА02) рекомендуется пациентам с ИМТ ≥27 кг/м 2 в сочетании с СД2, а также с ИМТ ≥30 кг/м 2 у пациентов с предиабетом (нарушенная толерантность к глюкозе (НТГ), нарушение гликемии натощак (НГН) или их сочетание) для снижения массы тела. Рекомендуется принимать препарат в начальной дозе 1 таблетка, содержащая 10 мг сибутрамина и 850 мг метформина в сутки. Препарат следует принимать утром, не разжевывая и запивая достаточным количеством жидкости как натощак, так и в сочетании с приемом пищи. Если в течение 4 нед от начала лечения не достигнуто снижение массы тела на 5% и более, то доза увеличивается до 15 мг сибутрамина + 850 мг метформина. Лечение не должно продолжаться более 3 мес у пациентов, которым не удалось за этот период добиться снижения массы тела на 5% от исходного уровня. Длительность лечения не более 1 года [20–22]. При необходимости возможно возобновление терапии через 3–6 месяцев (УУР В, УДД 1).
Комментарии. Совместное применение сибутрамина с метформином повышает терапевтическую эффективность используемой комбинации у пациентов с избыточной массой тела и нарушениями углеводного обмена. Препарат не следует принимать при наличии диабетического кетоацидоза, нарушении функции печени и почек (клиренс креатинина менее 45 мл/мин), а также при наличии противопоказаний к приему сибутрамина или метформина. Во время приема препарата следует избегать приема алкоголя, а также лекарственных средств, содержащих этанол.
2.24. Лираглутид (A10BJ02) — аналог человеческого глюкагоноподобного пептида-1 (ГПП-1), рекомендуется пациентам с ИМТ ≥30 кг/м 2 или ИМТ ≥27 кг/м 2 при наличии факторов риска и/или коморбидных заболеваний, начальная доза составляет 0,6 мг подкожно 1 раз в сутки, с последующей стандартной титрацией (доза увеличивается на 0,6 мг с интервалами не менее 1 нед для улучшения желудочно-кишечной переносимости до достижения терапевтической — 3,0 мг в сутки). При отсутствии снижения массы тела на 5% и более от исходной за 3 мес применения лираглутида в суточной дозе 3,0 мг лечение прекращают [23–27] (УУР А, УДД 1).
Комментарии. Лираглутид регулирует аппетит с помощью усиления чувства наполнения желудка и насыщения, одновременно ослабляя чувство голода и уменьшая предполагаемое потребление пищи. Лираглутид не увеличивает 24 часовой расход энергии. Лираглутид 3,0 мг обеспечивает эффективную и устойчивую потерю массы тела, положительно влияет на динамику кардиометаболических факторов риска на фоне снижения массы тела. Лираглутид 3,0 мг может рассматриваться как предпочтительный вариант для пациентов с ожирением и наличием сопутствующих ССЗ в связи с доказанным снижением сердечно-сосудистых рисков, устойчивым снижением массы тела в течение трех лет терапии, снижением тяжести ночного апноэ, значительным снижением риска развития СД2 и благоприятным профилем безопасности и переносимости. Препарат противопоказан при медуллярном раке щитовидной железы в анамнезе, в т.ч. семейном, множественной эндокринной неоплазии II типа, тяжелой депрессии, суицидальных мыслях или поведении, в т.ч. в анамнезе, почечной и печеночной недостаточности тяжелой степени, хронической сердечной недостаточности IV функционального класса (в соответствии с классификацией NYHA, у пациентов в возрасте ≥75 лет). Применение лираглутида у пациентов с воспалительными заболеваниями кишечника и диабетическим парезом желудка не рекомендуется, поскольку оно связано с транзиторными нежелательными реакциями со стороны ЖКТ, включая тошноту, рвоту и диарею. С осторожностью — прием препарата у пациентов с печеночной недостаточностью легкой и средней степени тяжести, заболеваниями щитовидной железы и наличием острого панкреатита в анамнезе.
2.25. При наличии у пациента с ожирением нарушений углеводного обмена, в том числе состояний, ассоциированных с инсулинорезистентностью (НГН, НТГ), с целью снижения риска развития СД2 или увеличения периода до его манифестации рекомендуется назначение метформина, лираглутида или комбинации метформина и сибутрамина, в том числе фиксированной [20–22, 24] (УУР B, УДД 2).

Таблица 4. Алгоритм выбора препаратов для фармакотерапии ожирения

СПИСОК ЛИТЕРАТУРЫ | REFERENCES
1. Biddle SJH, Bengoechea García E, Pedisic Z, et al. Screen Time, Other Sedentary Behaviours, and Obesity Risk in Adults: A Review of Reviews. Curr Obes Rep. 2017,6(2):134-147. doi: https://doi.org/10.1007/s13679-017-0256-9
2. Heymsfield SB, Wadden TA. Mechanisms, Pathophysiology, and Management of Obesity. Longo DL, ed. N Engl J Med. 2017,376(3):254-266. doi: https://doi.org/10.1056/NEJMra1514009
3. Guh DP, Zhang W, Bansback N, et al. The incidence of comorbidities related to obesity and overweight: A systematic review and meta-analysis. BMC Public Health. 2009,9:88. doi: https://doi.org/10.1186/1471-2458-9-88
4. Lenz M, Richter T, Mühlhauser I. The Morbidity and Mortality Associated With Overweight and Obesity in Adulthood. Dtsch Aerzteblatt Online. 2009,106:641-648. doi: https://doi.org/10.3238/arztebl.2009.0641
5. Avenell A, Brown TJ, McGee MA, et al. What are the long-term benefits of weight reducing diets in adults? A systematic review of randomized controlled trials. J Hum Nutr Diet. 2004,17(4):317-335. doi: https://doi.org/10.1111/j.1365-277X.2004.00531.x
6. Dansinger ML, Gleason JA, Griffith JL. et al. Comparison of the Atkins, Ornish, Weight Watchers, and Zone Diets for Weight Loss and Heart Disease Risk ReductionA Randomized Trial. JAMA. 2005,293(1):43-53. doi: https://doi.org/10.1001/jama.293.1.43
7. Stephens SK, Cobiac LJ, Veerman JL. Improving diet and physical activity to reduce population prevalence of overweight and obesity: An overview of current evidence. Prev Med (Baltim). 2014,62:167-178. doi: https://doi.org/10.1016/j.ypmed.2014.02.008
8. Garvey WT, Mechanick JI, Brett EM, et al. American Association of Clinical Endocrinologists and American College of Endocrinology Comprehensive Clinical Practice Guidelines Formedical Care of Patients with Obesity. Endocr Pract. 2016,22:1-203. doi: https://doi.org/10.4158/EP161365.GL
9. Rucker D, Padwal R, Li SK, et al. Long term pharmacotherapy for obesity and overweight: updated meta-analysis. BMJ. 2007,335(7631):1194-1199. doi: https://doi.org/10.1136/bmj.39385.413113.25
10. Avenell A, Broom J, Brown T, et al. Systematic review of the longterm effects and economic consequences of treatments for obesity and implications for health improvement. Health Technol Assess (Rockv). 2004,8(21). doi: https://doi.org/10.3310/hta8210.
11. Garvey WT, Mechanick JI, Brett EM, et al. American Association of Clinical Endocrinologists and American College of Endocrinology Comprehensive Clinical Practice Guidelines Formedical Care of Patients with Obesity. Endocr Pract. 2016,22(3):1-203. doi: https://doi.org/10.4158/EP161365.GL
12. Jensen MD, Ryan DH, Apovian CM, et al. 2013 AHA/ACC/TOS Guideline for the Management of Overweight and Obesity in Adults. J Am Coll Cardiol. 2014,63(25):2985-3023. doi: https://doi.org/10.1016/j.jacc.2013.11.004
13. Jensen MD, Ryan DH, Apovian CM, et al. 2013 AHA/ACC/TOS Guideline for the Management of Overweight and Obesity in Adults. Circulation. 2014,129(25 suppl 2):S102-S138. doi: https://doi.org/10.1161/01.cir.0000437739.71477.ee
14. Bray GA. Medical treatment of obesity: The past, the present and the future. Best Pract Res Clin Gastroenterol. 2014,28(4):665-684. doi: https://doi.org/10.1016/j.bpg.2014.07.015
15. Pucci A, Finer N. New Medications for Treatment of Obesity: Metabolic and Cardiovascular Effects. Can J Cardiol. 2015,31(2):142-152. doi: https://doi.org/10.1016/j.cjca.2014.11.010
16. Torgerson JS, Hauptman J, Boldrin MN, Sjostrom L. XENical in the Prevention of Diabetes in Obese Subjects (XENDOS) Study: A randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care. 2004,27(1):155-161. doi: https://doi.org/10.2337/diacare.27.1.155
17. Toplak H, Ziegler O, Keller U, et al. X-PERT: weight reduction with orlistat in obese subjects receiving a mildly or moderately reduced-energy diet. Early response to treatment predicts weight maintenance. Diabetes, Obes Metab. 2005,7(6):699-708. doi: https://doi.org/10.1111/j.1463-1326.2005.00483.x
18. Williamson DF, Pamuk E, Thun M, et al. Prospective Study of Intentional Weight Loss and Mortality in Overweight White Men Aged 40-64 Years. Am J Epidemiol. 1999,149(6):491-503. doi: https://doi.org/10.1093/oxfordjournals.aje.a009843
19. James WPT, Astrup A, Finer N, et al. Effect of sibutramine on weight maintenance after weight loss: a randomised trial. Lancet. 2000,356(9248):2119-2125. doi: https://doi.org/10.1016/S0140-6736(00)03491-7
20. Dedov II, Melnichenko GA, Troshina EA, et al. Body Weight Reduction Associated with the Sibutramine Treatment: Overall Results of the PRIMAVERA Primary Health Care Trial. Obes Facts. 2018,11(4):335-343. doi: https://doi.org/10.1159/000488880
21. Дедов И.И., Мельниченко Г.А., Романцова Т.И. Стратегия управления ожирением: итоги Всероссийской наблюдательной программы «ПримаВера» // Ожирение и метаболизм. — 2016. — Т.13 — №1. — С. 36-44. [Dedov II, Mel’nichenko GA, Romantsova TI. The strategy of obesity management: the results of All-Russian observational program “Primavera.” Obesity and metabolism. 2016,13(1):36-44. (In Russ.)]. doi: https://doi.org/10.14341/omet2016136-44
22. Knowler WC, Barrett-Connor E, Fowler SE, et al. Diabetes Prevention Program Research Group: Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med. 2002, 346:393–403. doi: https://doi.org/10.1056/NEJMoa012512
23. Pi-Sunyer X, Astrup A, Fujioka K, et al. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med. 2015,373(1):11-22. doi: https://doi.org/10.1056/NEJMoa1411892
24. le Roux CW, Astrup A, Fujioka K, et al. 3 years of liraglutide versus placebo for type 2 diabetes risk reduction and weight management in individuals with prediabetes: a randomised, double-blind trial. Lancet. 2017,389(10077):1399-1409. doi: https://doi.org/10.1016/s0140-6736(17)30069-7
25. Blackman A, Foster GD, Zammit G, et al. Effect of liraglutide 3.0 mg in individuals with obesity and moderate or severe obstructive sleep apnea: the SCALE Sleep Apnea randomized clinical trial. Int J Obes (Lond). 2016,40(8):1310-1319. doi: https://doi.org/10.1038/ij o.2016.52
26. Wadden TA, Hollander P, Klein S et al. Weight maintenance and additional weight loss with liraglutide after low-calorie-diet-induced weight loss: The SCALE Maintenance randomized study. International Journal of Obesity. 2013, 37:1443-1451. doi: https://doi.org/10.1038/ijo.2013.120
27. Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2016,375(4):311-22. doi: https://doi.org/10.1056/NEJMoa1603827
2.4. ПРИНЦИПЫ УДЕРЖАНИЯ СНИЖЕННОГО ВЕСА
Романцова Т.И.
ПОВТОРНЫЙ НАБОР МАССЫ ТЕЛА ПОСЛЕ ЕЕ СНИЖЕНИЯ, ПРИЧИНЫ РЕЦИДИВА ЗАБОЛЕВАНИЯ
Ожирение — хроническое, рецидивирующее, прогрессирующее заболевание [1]. Снижение массы тела на 5–10%существенно снижает кардиометаболический риск. Многим больным не удается сохранить уже достигнутые на фоне лечения показатели динамики массы тела [2, 3]. В среднем через 4–6 мес после начального, результативного этапа снижения массы тела, как правило, развивается период плато, который у ряда больных существенно снижает мотивацию к дальнейшему продолжению лечения. Период плато нередко переходит в фазу повторного увеличения массы тела. Повторный набор массы тела отмечается вне зависимости от вида применяемой терапии — на фоне изменения образа жизни, при использовании фармакотерапии, оперативного лечения. До половины потерянной массы тела вновь прибавляется уже в течение первого года терапии, в последующем масса тела может достичь исходных значений либо даже превзойти их [3, 4]. В развитии рецидива заболевания важную роль играет как субъективный, психологический фактор (снижение приверженности к лечению, «дезингибирование» самоконтроля), так и объективная, биологически обусловленная адаптация к снижению массы тела. В биологической адаптации задействовано множество механизмов. Отрицательный энергобаланс оказывает стрессорное воздействие на адипоциты, что приводит к резкому, диспропорциональному в отношении достигнутого снижения массы тела уменьшению выработки лептина [5]. Снижается содержание других анорексигенных гормонов: глюкагоноподобного пептида-1, пептида YY, холецистокинина, амилина, повышается содержание грелина. В ответ на периферические сигналы в дугообразных ядрах гипоталамуса повышается выработка анаболических нейромедиаторов — нейропептида Y и агути-подобного белка, снижается синтез катаболических нейромедиаторов — проопиомеланокортина и кокаин-амфетамин-регулируемого транскрипта [6, 7, 8]. Данные преобразования лежат в основе повышения аппетита. В адипоцитах развивается резистентность к катехоламин-индуцированному липолизу [9]. Снижение массы тела происходит за счет как жировой ткани, так и уменьшения массы «тощих» тканей, прежде всего скелетной мускулатуры [10]. Дефицит энергии приводит к метаболической адаптации энергозатрат. Отмечается снижение основного обмена, а также энергозатрат, обусловленных двигательной активностью и термическим динамическим действием пищи [11]. Таким образом, метаболическая адаптация обусловлена реорганизацией механизмов регуляции энергобаланса с целью максимального сохранения энергии в условиях ее критического дефицита. Характерные изменения содержания гормонов и снижение энергозатрат могут сохраняться свыше года после окончания периода снижения массы тела, в том числе даже после полного восстановления исходных значений ИМТ [8, 12]. В настоящее время не существует единых общепринятых критериев успешного снижения массы тела. В большинстве исследовательских работ успешные респондеры характеризуются как пациенты, снизившие массу тела на 10% и сохраняющие этот результат не менее года [13].
РЕКОМЕНДАЦИИ
2.26. Рекомендуется постановка реалистичных целей перед началом терапии, т.е. снижение массы тела на 5–10% за 6 мес, что сопровождается существенным улучшением показателей метаболического здоровья [2] (УДД 1, УУР А).
Комментарии. Нереалистичные цели (снижение массы тела на 30% и более за короткий промежуток времени) в последующем могут послужить причиной разочарования пациентов в эффективности лечения, снижении приверженности к терапии [14, 15]. При быстром снижении массы тела отмечаются более выраженные потери мышечной ткани, что негативно отражается на показателях энергозатрат [16].
2.27. Рекомендуется сохранение режима гипокалорийного питания. Состав макронутриентов основывается на индивидуальных предпочтениях больного и состоянии его здоровья [17, 18] (УДД 1, УУР А).
Комментарии. Успешное долгосрочное поддержание массы тела отмечается: 1) на фоне низкого содержания жиров в рационе, 2) при рационе, обогащенном пищевыми волокнами, источниками которых являются овощи и фрукты, 3) на фоне высокобелковой диетотерапии [17–19]. Повышение содержания белка (до 25–30% от суточной калорийности) способствует быстрому насыщению (предположительно, за счет активации секреции анорексигенных гормонов пептида YY и глюкагоноподобного пептида-1), а также характеризуется более высоким термическим эффектом [19, 20].
2.28. Рекомендуется сохранение режима повышенной физической активности: аэробная физическая активность (например, быстрая ходьба) от 200 до 300 мин в неделю, общие энергозатраты ≈2500 ккал в неделю [17] (УДД 2, УУР В).
Комментарии. Отмечается отрицательная зависимость между объемом физической активности и риском повторного набора массы тела. Расширение физической активности обеспечивает сохранность «тощих» тканей, уменьшает адаптивный термогенез. Успешные респондеры уделяют больше времени умеренной либо интенсивной физической активности по сравнению с нереспондерами при сопоставимых показателях массы тела [21, 22].
2.29. Рекомендуется назначение фармакотерапии при неэффективности немедикаментозных методов лечения или смена препаратов при неэффективности предшествующей медикаментозной терапии (выбор
препаратов — орлистат, сибутрамин (в т.ч. сибутрамин+метформин), лираглутид) (УДД 1, УУР А).
Комментарии. Применение указанных препаратов в сочетании с изменением образа жизни позволяет обеспечить более стойкое длительное поддержание массы тела по сравнению с плацебо [23–25]. Нецелесообразно продолжение приема ранее назначенного препарата для лечения ожирения при отсутствии клинически значимого снижения массы тела на 5–10% после 3–4 мес фармакотерапии.
2.30. Рекомендуется наблюдение пациента в процессе лечения не реже чем раз в месяц [26] (УДД 1, УУР А).
Комментарии. Консультации проводятся либо во время визита пациента в лечебное учреждение, либо дистанционно (по телефону, электронной почте). В ходе консультаций уточняется динамика массы тела, состояние здоровья с учетом ассоциированных заболеваний, мотивация к продолжению лечения, при необходимости — смена тактики терапии [26, 27].
2.31. Рекомендуется постоянный самостоятельный мониторинг массы тела, ведение дневника питания и контроля физических нагрузок: ежедневное (предпочтительно) либо еженедельное взвешивание. Мониторинг приема пищи — размера порций, суточного калоража. Мониторинг физической активности [20, 27, 28, 29] (УДД 1, УУР А).
СПИСОК ЛИТЕРАТУРЫ | REFERENCES
1. Bray GA, Kim KK, Wilding JPH, et al. Obesity: a chronic relapsing progressive disease process. A position statement of the World Obesity Federation. Obes Rev. 2017,18(7):715-723. doi: https://doi.org/10.1111/obr.12551.
2. Magkos F, Fraterrigo G, Yoshino J. et al. Effects of Moderate and Subsequent Progressive Weight Loss on Metabolic Function and Adipose Tissue Biology in Humans with Obesity. Cell Metab, 2016,23:1-11. doi: https://doi.org/10.1016/j.cmet.2016.02.005
3. McGuire MT, Wing RR, Hill JO. The prevalence of weight loss maintenance among American adults. Int J Obes Relat Metab Disord. 1999,23:1314-1319. doi: https://doi.org/10.1038/sj.ijo.0801075
4. Dulloo AG, Jacquet J, Girardier L. Poststarvation hyperphagia and body fat overshooting in humans: a role for feedback signals from lean and fat tissues. Am J Clin Nutr. 1997,65(3):717-723. doi: https://doi.org/10.1093/ajcn/65.3.717
5. Roumans NJT, Vink RG, Bouwman FG, et al. Weight-loss stress in subcutaneous adipose tissue is related to weight regain. Int J Obes (Lond). 2017,41(6):894-901. doi: https://doi.org/10.1038/ijo.2016.221
6. Crujeiras AB, Goyenechea E, Abete I, et al. Weight Regain after a Diet-Induced Loss Is Predicted by Higher Baseline Leptin and Lower Ghrelin Plasma Levels. J Clin Endocrinol Metab. 2010,95(11):5037-5044. doi: https://doi.org/10.1210/jc.2009-2566
7. Hinkle W, Cordell M, Leibel R, et al. Effects of reduced weight maintenance and leptin repletion on functional connectivity of the hypothalamus in obese humans. PLoS One. 2013,8:e59114. doi: https://doi.org/10.1371/journal.pone.0059114.
8. Sumithran P, Prendergast LA, Delbridge E, et al. Long-term persistence of hormonal adaptations to weight loss. N Engl J Med . 2011,365:1597-1604. doi: https://doi.org/10.1056/NEJMoa1105816
9. Kasher-Meron M, Youn DY, Zong H, Pessin JE. Lipolysis defect in white adipose tissue and rapid weight regain. Am J Physiol Metab. 2019,317(2):E185-E193. doi: https://doi.org/10.1152/ajpendo.00542.2018
10. Sparti A, DeLany JP, de la Bretonne JA, et al. Relationship between resting metabolic rate and the composition of the fat-free mass. Metabolism. 1997,46:1225-1230. doi: https://doi.org/10.1016/S0026-0495(97)90222-5
11. Leibel RL, Rosenbaum M, Hirsch J. Changes in Energy Expenditure Resulting from Altered Body Weight. N Engl J Med. 1995,332(10):621- 628. doi: https://doi.org/10.1056/NEJM199503093321001
12. Rosenbaum M, Hirsch J, Gallagher DA, Leibel RL. Long-term persistence of adaptive thermogenesis in subjects who have maintained a reduced body weight. Am J Clin Nutr. 2008,88:906-912. doi: https://doi.org/10.1093/ajcn/88.4.906
13. Wing RR, Hill JO. Successful weight loss maintenance. Annu Rev Nutr 2001,21:323-341. doi: https://doi.org/10.1146/annurev.nutr.21.1.323
14. DeJesus RS, Bauer KW, Bradley DP, et al. Experience and expectations of patients on weight loss: The Learning Health system Network experience. Obesity Science & Practice. 2019,5(5):479-486. doi: https://doi.org/10.1002/osp4.364
15. Preuss H, Leister L, Pinnow M, Legenbauer T. Inhibitory control pathway to disinhibited eating: A matter of perspective? Appetite. 2019,141(2):104297. doi: https://doi.org/10.1016/j.appet.2019.05.028
16. Vink RG, Roumans NJT, Arkenbosch LAJ, et al. The effect of rate of weight loss on long-term weight regain in adults with overweight and obesity. Obesity. 2016,24(2):321-327. doi: https://doi.org/10.1002/oby.21346
17. Jensen MD, Ryan DH, Apovian CM, et al. 2013 AHA/ACC/TOS Guideline for the Management of Overweight and Obesity in Adults. Circulation. 2014,129(25 suppl 2):S102-S138. doi: https://doi.org/10.1161/01.cir.0000437739.71477.ee
18. Bray GA, Heisel WE, Afshin A, et al. The Science of Obesity Management: An Endocrine Society Scientific Statement. Endocr Rev. 2018,39(2):79-132. doi: https://doi.org/10.1210/er.2017-00253
19. Aller EE, Larsen TM, Claus H, et al. Weight loss maintenance in overweight subjects on ad libitum diets with high or low protein content and glycemic index: the DIOGENES trial 12-month results. Int. J. Obes. (Lond.). 2014,38:1511-1517. doi: https://doi.org/10.1038/ijo.2014.52
20. Varkevisser RDM, van Stralen MM, Kroeze W, et al. Determinants of weight loss maintenance: a systematic review. Obes Rev. 2019,20(2):171-211. doi: https://doi.org/10.1111/obr.12772
21. Schoeller DA, Shay K, Kushner RF. et al. How much physical activity is needed to minimize weight gain in previously obese women? Am J Clin Nutr. 1997,66(3):551-556. doi: https://doi.org/10.1093/ajcn/66.3.551.
22. Ostendorf DM, Caldwell AE, Creasy SA, et al. Physical Activity Energy Expenditure and Total Daily Energy Expenditure in Successful Weight Loss Maintainers. Obesity (Silver Spring). 2019,27(3):496-504. doi: https://doi.org/10.1002/oby.22373
23. James WTP, Astrup A, Finer N, et al. The STORM Study Group. Effect of sibutramine on weight maintenance after weight loss: a randomised trial. Lancet. 2000,356:2119–2125. doi: https://doi.org/10.1016/S0140-6736(00)03491-7
24. Richelsen B, Tonstad S, Rössner S, et al. Effect of orlistat on weight regain and cardiovascular risk factors following a very-lowenergy diet in abdominally obese patients: a 3-year randomized, placebo-controlled study. Diabetes Care. 2007,30(1):27-32. doi: https://doi.org/10.2337/dc06-0210
25. Wadden TA, Hollander P, Klein S, et al. Weight maintenance and additional weight loss with liraglutide after lowcalorie-diet-induced weight loss: the SCALE Maintenance randomized study. Int J Obes (Lond). 2013,37(11):1443-51. doi: https://doi.org/10.1038/ijo.2013.120.
26. Dutton GR, Gowey MA, Tan F. Comparison of an alternative schedule of extended care contacts to a self-directed control: a randomized trial of weight loss maintenance. Int J Behav Nutr Phys Act. 2017,14(1):107. doi: https://doi.org/10.1186/s12966-017-0564-1
27. Wing RR, Tate DF, Gorin AA, et al. A Self-Regulation Program for Maintenance of Weight Loss. N Engl J Med. 2006,355(15):1563-1571. doi: https://doi.org/10.1056/NEJMoa061883
28. Ostendorf DM, Lyden K, Pan Z, et al. Objectively measured physical activity and sedentary behavior in successful weight loss maintainers. Obesity (Silver Spring). 2018,26(1):53-60. doi: https://doi.org/10.1002/oby.22052
29. Crain AL, Sherwood NE, Martinson BC, Jeffery RW. Mediators of Weight Loss Maintenance in the Keep It Off Trial. Ann Behav Med. 2018,52(1):9-18. doi: https://doi.org/10.1007/s12160-017-9917-x
2.5. ФИЗИЧЕСКАЯ РЕАБИЛИТАЦИЯ И ДВИГАТЕЛЬНАЯ АКТИВНОСТЬ ПАЦИЕНТОВ С ОЖИРЕНИЕМ
Чечельницкая С.М.
ФИЗИЧЕСКАЯ РЕАБИЛИТАЦИЯ И ДВИГАТЕЛЬНАЯ АКТИВНОСТЬ ПАЦИЕНТОВ С ОЖИРЕНИЕМ
Физическая терапия пациентов с ожирением складывается из двух взаимосвязанных и взаимопотенцирующих направлений: оптимизация двигательной активности и физическая реабилитация.
Цель оптимизации двигательной активности — увеличение расходов энергии для постепенного монотонного снижения веса пациента (5–10% в год) до оптимального для него уровня и удержание достигаемых результатов на длительный период. Она достигается за счет определения объемов, интенсивности, характера и режима нагрузок.
Цель физической реабилитации — обеспечить пациенту возможность активно двигаться за счет устранения нарушений, препятствующих выполнению физических нагрузок и адекватной двигательной активности (хронические кардиологические заболевания, контрактуры суставов, выраженные нарушения ходьбы, дистрофия скелетных мышц, низкая переносимость физических нагрузок и т.д.).
Задачи физической реабилитации:
- уменьшение болевых ощущений,
- улучшение функционирования сердечно-сосудистой и дыхательной систем,
- повышение мышечной силы,
- улучшение качества движения,
- повышение гибкости и улучшение осанки,
- повышение уровня двигательной активности.
Ведущие принципы физической реабилитации:
- деятельность строится на холистическом подходе — реабилитационные задачи формулируются совместно пациентом, лечащим врачом, реабилитологом и психологом,
- методы, средства и режим реабилитации выбираются на основе результатов современной инструментальной диагностики,
- персональные реабилитационные программы составляются с учетом личных предпочтений пациента, возможности пациента и его ближайшего окружения обеспечить их выполнение самостоятельно,
- неотъемлемой частью реабилитационной программы являются инструменты контроля полноты и качества выполнения требований, этапного контроля эффективности,
- реабилитационный процесс ведется длительное время (1,5–2 года) в смешанном режиме: очные сессии, дистанционная поддержка в межгоспитальный период.
РЕКОМЕНДАЦИИ
Сроки и целевые ориентиры
2.32. Рекомендуемая продолжительность программ физической реабилитации должна составлять не менее 12 нед (УДД 1, УУР А).
Комментарии. По данным ряда исследований, при продолжительности занятий 12 нед и более значимо снижаются показатели веса, ИМТ, окружность талии и содержание жировой ткани в организме. Продолжительность курса 12 нед и оказывает существенное влияние на липидный профиль пациентов, приводя к снижению уровня ЛПВП [1]. Менее продолжительные курсы не дают подобного эффекта. Максимальное снижение массы тела отмечено при продолжительности тренировок в течение 16 нед (4 мес).
2.33. Двигательная активность в программах реабилитации пациентов с ожирением носит вспомогательный характер и не рекомендуется как монотерапия. Клиническая эффективность комплексных программ поведенческого контроля веса, по сравнению с однокомпонентными программами (диетотерапии или физическая активность), выше (УДД 1, УУР А).
Комментарии. Систематический обзор A. Thorogood и соавт. показал, что ценность физических упражнений как самостоятельного средства снижения веса для групп с избыточным весом и ожирением ограничена [2]. В то же время аэробные упражнения обеспечивают снижение риска сердечно-сосудистых заболеваний и уровня липидов и могут иметь ценность как часть комплексной программы, включающей диетотерапию.
В краткосрочной перспективе потеря веса одинакова для диетических и комбинированных программ, но в долгосрочной перспективе потеря веса увеличивается при сочетании диеты и физической активности. Программы, основанные только на физической активности, менее эффективны, чем комбинированные как в краткосрочной, так и в долгосрочной перспективе [3].
Физические упражнения являются обязательной частью лечения ожирения, так как улучшают кардиореспираторную подготовку и состояние скелетных мышц, что помогает предотвратить саркопеническое ожирение [4]. Систематический обзор Conn V.S. и соавт. показал, что одним из наиболее важных преимуществ двигательной активности может быть предотвращение увеличения веса [5].
2.34. Не рекомендуется ставить перед пациентом с ожирением цель доведения веса до половозрастной нормы, так как она недостижима. Снижение веса у пациентов должно происходить постепенно, оптимальный целевой показатель 1-й ступени — снижение веса на 5% в течение 6 мес с удержанием этого показателя в последующий период (УДД 2, УУР В).
Комментарии. В наблюдательных исследованиях (9 лет) Fildes A. и соавт. наблюдали, как правило, циклическое изменение веса в категории патологического ожирения. Ряд авторов сообщали о большей нестабильности результатов среди пациентов с более высоким ИМТ. Циклическое изменение веса сопровождается более высоким риском заболеваемости и смертности, чем стабильное ожирение, хотя доказательства причинной связи остаются неубедительными [6]. Было показано, что не менее 50% пациентов, потерявших 5% массы тела, вернули этот вес в течение 2 лет. Ранее сообщалось, что примерно 80% людей, которые намеренно достигают потери веса на 10% или более от своего веса, восстанавливают эту потерю. В связи с этим в материалах ВОЗ говорится, что «здоровая потеря веса — это не просто «диета» или «программа». Речь идет о постоянном образе жизни, который включает в себя долгосрочные изменения в ежедневных привычках питания и физических упражнениях».
2.35. В отношении пациентов с ожирением не рекомендуется применять универсальный подход при определении целевых показателей снижения веса (УДД 2, УУР В).
Комментарии. Снижение веса не является самоцелью при реабилитации пациентов с ожирением. Физическая реабилитация в большей степени направлена на предупреждение заболеваний сердечно-сосудистой, дыхательной и костно-мышечной систем, вызываемых ожирением. Существуют убедительные доказательства того, что у пациентов с сердечно-сосудистыми заболеваниями избыточный вес и умеренное ожирение (т.е. ИМТ здорового питания, двигательной активности и улучшения кардиореспираторной подготовки [7].
Оптимизация двигательной активности
По определению ВОЗ, физическая (двигательная) активность — это какое-либо движение тела, производимое скелетными мышцами, которое требует расхода энергии. Термин «физическая активность» относится к любым видам движений, в том числе во время отдыха, поездок в какие-либо места и обратно или во время работы.
2.36. При расчете объемов двигательной активности для пациентов, лечащихся от ожирения, рекомендуется учитывать все виды физических действий (УДД 2, УУР А).
Комментарии. В обзоре А. Данна (2009 г.) анализируется концепция, согласно которой, образ жизни имеет такую же эффективность в контроле веса, как и структурированные программы упражнений. Сделан вывод, что вмешательства в образ жизни обладают способностью улучшать исходы ССЗ, хотя отмечается краткосрочный характер многих исследований, подтверждающих этот вывод, и важность будущих исследований, направленных на поддержание такого образа жизни [8]. По мнению P. Кушнера, консультирование по снижению веса должно поощрять как структурированные упражнения, так и физическую активность, связанную с образом жизни, как часть лечения ожирения [9].
2.37. Рекомендовано, чтобы большая часть ежедневной двигательной активности приходилась на аэробные физические нагрузки, то есть соответствовала нагрузке умеренной интенсивности (УДД 1, УУР А).
Комментарии. Интенсивность физических нагрузок — понятие индивидуальное, зависящее от физической подготовленности пациента. Она определяется по реакции сердечно-сосудистой системы на нагрузку. При нагрузке низкой интенсивности пульс достигает 50–60% максимального. Для физической активности умеренной интенсивности целевая частота пульса должна составлять от 64 до 76% максимальной частоты пульса. Для физической активности с высокой интенсивностью целевая частота пульса — от 77 до 93% максимальной частоты пульса. Максимальную частоту сердечных сокращений можно рассчитать по формуле Карванена (220 — возраст).
Для индивидуального использования во время тренировок можно применять более простой способ измерения относительной интенсивности — тест разговора. Если упражнения средней интенсивности, пациент может говорить, но не петь во время упражнения. Если упражнения более интенсивны, он не сможет сказать больше нескольких слов, не делая паузу для дыхания. Для измерения уровня интенсивности физической активности также широко применяется тест-рейтинг воспринимаемого напряжения Борга. Он основан на физических ощущениях, которые испытывает человек, включая учащенное сердцебиение, учащенное дыхание или одышку, повышенное потоотделение и мышечную усталость. Каждая позиция шкалы оценивается в баллах от 6 (полное отсутствие усилий) до 20 (максимальное усилие). Практики, как правило, соглашаются с тем, что воспринимаемые уровни нагрузки от 12 до 14 по шкале Борга предполагают, что физическая активность выполняется с умеренным уровнем интенсивности, более 14 — с высоким уровнем.
2.38. При физической реабилитации пациентов с ожирением важно обеспечить адекватный недельный объем двигательной активности, обеспечивающий опережающий расход энергии по отношению к энергии, поступающей с пищей (УДД 2, УУР А).
Комментарии. При планировании объемов двигательной активности целесообразно использовать метрическую единицу для универсальной оценки физических затрат — MET (метаболический эквивалент физической деятельности). МЕТ — количество кислорода, поглощаемого человеком в покое за 1 мин в пересчете на 1 кг его веса. На основе многочисленных измерений для взрослых людей принято считать 1 МЕТ=3,5 мл О2/кг/мин. Во время любой деятельности, включая компьютерные игры и домашнюю работу, человек затрачивает количество кислорода, кратное 1 МЕТ. Например, при выполнении гимнастических упражнений человек тратит 2,7 МЕТ в минуту. Если он занимался активно в течение 30 мин, потратил 81 МЕТ. Наиболее распространенной рекомендацией по объему энергетических затрат является уровень 3000–4000 МЕТ в неделю.
Для различных видов активности разработана градация по интенсивности нагрузок в МЕТ:
- крайне низкой интенсивности (сидячие), например, компьютерные игры лежа, — до 1,5 МЕТ,
- низкой интенсивности, например, письмо от руки, складывание белья, подметание пола, — от 1,5 до 3 МЕТ,
- средней интенсивности, например, быстрая ходьба по земле, — от 3 до 6 МЕТ,
- высокой интенсивности, например, игра в баскетбол, бег на скорость, — более 6 МЕТ.
Для подсчета недельных энергетических затрат удобно пользоваться справочниками, в которых приводятся усредненные энергозатраты на измеренные виды активности. Примером такого источника является Компендиум Arizona State University and National Cancer Institute (https://sites.google.com/site/compendiumofphysicalactivities/ home). В том случае, если специалист или пациент не нашел необходимый ему вид активности, рекомендуется подбирать аналогичное по интенсивности занятие и ориентироваться на его энергетическую стоимость. Например, спокойная ходьба вверх по лестнице, по сути, является кардиореспираторной тренировкой с умеренной интенсивностью.
Суммарные энергетические затраты складываются из затрат на повседневные дела, работу, передвижения, прогулки и т.д.
На этом принципе построены многочисленные анкеты самоконтроля и профессиональной супервизии, например, International physical activity questionnaire (IPAQ). На сайте https://sites.google.com/site/theipaq/ размещены опросники IPAQ на многих языках мира, при заполнении которых онлайн-программа выдает результат недельной активности в МЕТ.
После заполнения опросника суммируются все часы и минуты активности из первых 4 частей по умеренным нагрузкам и умножаются на средние цифры МЕТ умеренной нагрузки:
[(часы × 60 мин) + минуты] × кол-во дней в неделю × 4,5 (средняя цена за умеренную нагрузку в МЕТ) = МЕТ в неделю.
Так же вычисляется затраты на интенсивную физическую нагрузку:
[(часы × 60 мин) + минуты] × кол-во дней в неделю × 8 (средняя цена за интенсивную нагрузку в МЕТ) = МЕТ в неделю.
Для оценки энергии, затраченной маломобильными пациентами, дополнительно существует 5-я часть, которая анализирует нагрузки низкой интенсивности — до 3 МЕТ. Принцип подсчета прежний.
Сумма МЕТ легкой, умеренной и интенсивной нагрузок определяет среднюю физическую активность в неделю.
Подобный подход обеспечивает высокую вариативность двигательного режима. Пациент с низкой переносимостью физических нагрузок или в период интеркуррентного заболевания, плохого самочувствия может составить
свой двигательный рацион из более длительных низкоинтенсивных занятий. При хорошем самочувствии желательно
повысить интенсивность нагрузок, сократив при этом их время.
Физические упражнения
2.39. Поскольку у многих людей с ожирением снижена кардиореспираторная подготовка, они не знакомы с физическими упражнениями и имеют повышенный риск травм опорно-двигательного аппарата из-за избыточной массы тела и нарушений постуральной устойчивости, важно назначать упражнения, которые безопасны и позволяют им чувствовать себя комфортно, тем самым обеспечивая соблюдение программы тренировок. Рекомендуется, чтобы упражнения проводились под контролем специализированного тренера, по крайней мере, в начальный период (УДД 2, УУР В).
Комментарии. Тип упражнения — это параметр, который следует учитывать при лечении ожирения. Упражнения на выносливость являются самым популярным и эффективным видом упражнений для похудания, так как они легко применимы для людей с ожирением и обеспечивают высокий расход энергии. Упражнения с отягощениями и периодические упражнения также могут быть включены в программу управления весом, предлагая разнообразие и дополнительные положительные эффекты на показатели здоровья и физической формы. Они могут влиять на массу тела, увеличивая безжировую массу, что повышает скорость метаболизма в состоянии покоя. Однако поскольку упражнение с отягощениями включает длительные интервалы отдыха, его расход энергии низок по сравнению с непрерывными упражнениями на выносливость.
Упражнения с сопротивлением также улучшают мышечную силу, что может привести к более высокой физической активности и, следовательно, к увеличению общих суточных затрат энергии, хотя следует соблюдать осторожность из-за повышенного риска мышечно-скелетных травм, связанных с этим видом упражнений.
Интервальная тренировка высокой интенсивности (ИТВИ) характеризуется короткими сериями упражнений высокой интенсивности, чередующимися с периодами отдыха или упражнениями низкой интенсивности. ИТВИ в последнее время стала популярной стратегией похудания среди населения в целом [10]. Также было показано, что такой режим тренировки хорошо переносится людьми с ожирением. Согласно метаанализу Джеллеймана и соавт. [11], ИТВИ вызвала значительное снижение массы тела, на 1,3 кг, по сравнению с контрольными группами без упражнений, но не по сравнению с непрерывными тренировками средней интенсивности. По-видимому, оба этих вида тренировок одинаково эффективны в снижении жировых отложений даже при отсутствии изменений массы тела у тучных людей. Преимуществом является то, что ИТВИ требует примерно на 40% меньше времени [12]. Метаанализ, проведенный Тюрком и соавт. [13], показал значительное снижение процентного содержания жира в организме при ИТВИ по сравнению с «традиционными» упражнениями, но при этом не показано выраженного снижения веса, ИМТ или уменьшения ОТ.
Согласно P. Де Фео (2013), большое значение имеет постепенное увеличение физической нагрузки в процессе выполнения упражнений [14]. Наиболее эффективный режим повышения нагрузок для людей с ожирением — это начинать с умеренной интенсивности и увеличивать ее на 5% каждые шесть тренировок, до 65% от максимальной нагрузки. После того, как будет достигнута достаточная адаптация, лучше добавить короткие повторения интервальных тренировок с субмаксимальной интенсивностью.
2.40. Выполнение физических упражнений является частью двигательной активности и должно учитываться в общей недельной нагрузке. Продолжительность занятий физическими упражнениями должна превышать рекомендованную для здоровых лиц в 1,5–2 раза (УДД 2, УУР С).
Комментарии. Рекомендуемые для общей популяции минимальные уровни физической активности (примерно 150 мин упражнений средней интенсивности в неделю) без ограничений в питании могут вызвать умеренную потерю веса (около 2–3 кг), но недостаточны для клинически значимой потери веса (≥5%). Для похудания и успешного долгосрочного контроля веса необходимо больше физических нагрузок (от 225 до 420 мин упражнений в неделю) [15]. Подсчитано, что каждые 50 мин физических упражнений в неделю приводят к потере около 1 кг за 6-месячный период. Итак, если заниматься по 250 мин каждую неделю, можно ожидать потери 5 кг за 6 мес (то есть только от упражнений).
Разделение ежедневного расписания упражнений на несколько коротких периодов, по данным исследователей, является таким же эффективным в управлении весом, как выполнение упражнений в одно занятие [16].
2.41. Для пациентов с ожирением должны разрабатываться персональные программы физических упражнений, учитывающие физические характеристики пациента, его ограничения, связанные с ожирением, осложнениями и сопутствующими заболеваниями (УДД 2, УУР В).
Комментарии. Персональная программа физических упражнений должна составляться на основе результатов диагностики функционального состояния релевантных органов и систем пациента.
Диагностика физического статуса пациента позволяет одновременно получить необходимую информацию для разработки персональной программы физической реабилитации и разработать перечень показателей для оценки эффективности и действенности предпринимаемых мер. Соответственно, она включает достаточно широкий спектр процедур, перечисленных ниже.
Физикальное обследование, фиксация антропометрических показателей: масса тела, длина тела, окружности талии, бедер, голеней и плеч. С целью выявления саркопенического ожирения проводится исследование компонентного состава тела методом биоимпедансометрии. Определяется процент жировой, тощей и мышечной масс. По итогам обследования проводится консилиум команды специалистов с участием пациента: лечащий врач, реабилитолог, методист лечебной физической культуры (ЛФК), психолог.
Роли участников консилиума распределяются следующим образом:
- лечащий врач информирует об особенностях течения заболевания у пациента, осложнениях и коморбидных заболеваниях, функциональном состоянии сердечно-сосудистой и дыхательной систем,
- пациент рассказывает о существующих ограничениях в физическом функционировании и опыте занятий физической культурой, спортом, предъявляет актуальные жалобы, принимает решение о выборе средств и методов физической реабилитации из числа предлагаемых специалистами,
- реабилитолог анализирует результаты проведенных диагностических мероприятий, информацию от лечащего врача и пациента и формулирует реабилитационные задачи, определяя последовательность их решения,
- методист ЛФК предлагает средства и методы адаптивной физической культуры, двигательной активности и лечебной гимнастики, позволяющие решать поставленные задачи.
При составлении персональной программы физической реабилитации может использоваться широкий спектр методик ЛФК, которые применяются для решения конкретных задач восстановления функций сердечно-сосудистой и легочной систем, периферической нервной системы и опорно-двигательного аппарата (кардиотренировки, дыхательные упражнения, стрейчинг, суставная гимнастика, ушу, элементы йоги, изометрические силовые упражнения, упражнения с отягощением, работа на тренажерах с собственным весом, лечебная гимнастика, кинезитерапия, аквакинезитерапия и т.д. и т.п.).
Тренировки должны проводиться на регулярной основе, не реже 3 раз в неделю. Тренировки низкой или умеренной интенсивности должны занимать в совокупности не менее 5 ч в неделю, тренировки высокой интенсивности — не менее 3 ч.
Во все комплексы облигатно, желательно в разминочной части, должны включаться упражнения кардиологической и респираторной направленности. Неотъемлемой составляющей основной части занятия должны быть упражнения, направленные на повышение силовой выносливости скелетных мышц и объемов движений в отдельных суставах, укрепление костей. Основная часть должна наполняться упражнениями с учетом всех известных персональных особенностей пациента.
Обязательная часть персональной программы физической реабилитации — контроль эффективности и действенности. Необходимо предусмотреть текущий контроль в виде заполнения самоотчетов по выполняемым нагрузкам и простым, но информативным тестам. Этапный контроль должен включать проведение инструментального обследования по диагностическому протоколу, который применялся в подготовительный период.
Занятия могут проводиться как в очной, так и в заочной форме при информационной поддержке врача-реабилитолога и методиста ЛФК. Очные занятия признаются более эффективными, но даже дистанционное сопровождение пациента обеспечивает достаточный эффект.
СПИСОК ЛИТЕРАТУРЫ | REFERENCES
1. Kim K-B, Kim K, Kim C, et al. Effects of Exercise on the Body Composition and Lipid Profile of Individuals with Obesity: A Systematic Review and Meta-Analysis. J Obes Metab Syndr. 2019,28(4):278-294. doi: https://doi.org/10.7570/jomes.2019.28.4.278
2. Thorogood A, Mottillo S, Shimony A, et al. Isolated Aerobic Exercise and Weight Loss: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Am J Med. 2011,124(8):747-755. doi: https://doi.org/10.1016/j.amjmed.2011.02.037
3. Johns DJ, Hartmann-Boyce J, Jebb SA, Aveyard P. Diet or Exercise Interventions vs Combined Behavioral Weight Management Programs: A Systematic Review and Meta-Analysis of Direct Comparisons. J Acad Nutr Diet. 2014,114(10):1557-1568. doi: https://doi.org/10.1016/j.jand.2014.07.005
4. Hamasaki H. Physical Activity and Obesity in Adults. In: Adiposity - Epidemiology and Treatment Modalities. Vol 13. InTech, 2017:36-44. doi: https://doi.org/10.5772/64672
5. Conn VS, Hafdahl A, Phillips LJ, et al. Impact of Physical Activity Interventions on Anthropometric Outcomes: Systematic Review and Meta-Analysis. J Prim Prev. 2014,35(4):203-215. doi: https://doi.org/10.1007/s10935-014-0352-5
6. Fildes A, Charlton J, Rudisill C, et al. Probability of an Obese Person Attaining Normal Body Weight: Cohort Study Using Electronic Health Records. Am J Public Health. 2015,105(9):e54-e59. doi: https://doi.org/10.2105/AJPH.2015.302773
7. Ortega FB, Lavie CJ, Blair SN. Obesity and Cardiovascular Disease. Circ Res. 2016,118(11):1752-1770. doi: https://doi.org/10.1161/CIRCRESAHA.115.306883
8. Dunn AL. Effectiveness of Lifestyle Physical Activity Interventions to Reduce Cardiovascular Disease. Am J Lifestyle Med. 2009,3(1):11S-18S. doi: https://doi.org/10.1177/1559827609336067
9. Kushner RF. Weight Loss Strategies for Treatment of Obesity. Prog Cardiovasc Dis. 2014,56(4):465-472. doi: https://doi.org/10.1016/j.pcad.2013.09.005
10. Obert J, Pearlman M, Obert L, Chapin S. Popular Weight Loss Strategies: a Review of Four Weight Loss Techniques. Curr Gastroenterol Rep. 2017,19(12):61. doi: https://doi.org/10.1007/s11894-017-0603-8
11. Jelleyman C, Yates T, O’Donovan G, et al. The effects of highintensity interval training on glucose regulation and insulin resistance: a meta-analysis. Obes Rev. 2015,16(11):942-961. doi: https://doi.org/10.1111/obr.12317
12. Wewege M, van den Berg R, Ward RE, Keech A. The effects of highintensity interval training vs. moderate-intensity continuous training on body composition in overweight and obese adults: a systematic review and meta-analysis. Obes Rev. 2017,18(6):635-646. doi: https://doi.org/10.1111/obr.12532
13. Türk Y, Theel W, Kasteleyn MJ, et al. High intensity training in obesity: a Meta-analysis. Obes Sci Pract. 2017,3(3):258-271. doi: https://doi.org/10.1002/osp4.109
14. De Feo P. Is high-intensity exercise better than moderate-intensity exercise for weight loss? Nutr Metab Cardiovasc Dis. 2013,23(11):1037-1042. doi: https://doi.org/10.1016/j.numecd.2013.06.002
15. Sword DO. Exercise as a Management Strategy for the Overweight and Obese. Strength Cond J. 2012,34(5):47-55. doi: https://doi.org/10.1519/SSC.0b013e31826d9403
16. Fogelholm M, Stallknecht B, Van Baak M. ECSS position statement: Exercise and obesity. Eur J Sport Sci. 2006,6:15–24. doi: https://doi.org/10.1080/17461390600563085
ГЛАВА 3. ОЖИРЕНИЕ И НАРУШЕНИЯ УГЛЕВОДНОГО ОБМЕНА
Шестакова М.В., Шестакова Е.А.
Наличие сопутствующей патологии зачастую изменяет подход к терапии основного заболевания. Как наличие ожирения у пациента с СД2, так и наличие СД2 у пациента с ожирением будет видоизменять тактику лечения.
ВЛИЯНИЕ ОЖИРЕНИЯ НА ВЫБОР ТАКТИКИ ЛЕЧЕНИЯ СД2
Выбор терапии пациентов с СД2 происходит в несколько этапов: постановка адекватной цели терапии, старт сахароснижающей терапии, своевременная интенсификация терапии, коррекция терапии в зависимости от эффективности лечения/наличия сопутствующих заболеваний/побочных эффектов и т.д.
Выбор целей лечения СД2 не зависит от наличия у пациента избыточной массы тела или ожирения. Целью терапии пациентов с СД является определенный врачом уровень гликированного гемоглобина (HbA1c) в диапазоне от 6,5% до 8,5% [1]. На целевой уровень HbA1c влияют возраст пациента, ожидаемая продолжительность жизни, функциональная зависимость, наличие атеросклеротических сердечно-сосудистых заболеваний, риск тяжелой гипогликемии.
В то же время выбор сахароснижающего агента будет во многом определяться наличием у пациента ожирения. Среди сахароснижающих препаратов есть группы как снижающих, так и увеличивающих массу тела.
ВЛИЯНИЕ СД2 НА ВЫБОР ТАКТИКИ ЛЕЧЕНИЯ ПРИ ОЖИРЕНИИ
Терапия пациентов с ожирением состоит из трех компонентов: немедикаментозный подход, лекарственная терапия и хирургическое лечение. Наличие у пациента с ожирением СД2 будет влиять на выбор режима питания, интенсивности физической нагрузки, а также определять более скорый переход к хирургическому лечению ожирения.
Немедикаментозный подход, или изменение образа жизни, в лечении ожирения является первоочередным и базируется на двух принципах: диетотерапии и увеличении режима физических упражнений. При неэффективности данного подхода возможно назначение медикаментозного и хирургического методов лечения, особенности которых будут рассмотрены в соответствующих разделах.
РЕКОМЕНДАЦИИ
Диагностика нарушений углеводного обмена при ожирении
3.1. Диагностические критерии нарушений углеводного обмена (ВОЗ, 1999–2013) одинаковы для всех пациентов вне зависимости от наличия избыточной массы тела или ожирения (УДД 1, УУР А).
Комментарии. Диагностические критерии нарушений углеводного обмена (СД и предиабетических состояний) одинаковы при ожирении и нормальной массе тела. Согласно «Алгоритмам специализированной медицинской помощи больным сахарным диабетом» 2019 г., для диагностики нарушений углеводного обмена следует использовать критерии ВОЗ [1] (табл. 5). В 2011 г. ВОЗ одобрила возможность использования HbA1c для диагностики СД. В качестве диагностического критерия СД выбран уровень HbA1c ≥6,5% (48 ммоль/моль). Данный уровень гликированного гемоглобина используется как критерий диагностики СД и у лиц с ожирением.
Нормальным считается уровень HbA1c до 6,0% (42 ммоль/моль). Согласно рекомендациям ВОЗ, уровень HbA1c 6,0–6,4% (42–47 ммоль/моль) сам по себе не позволяет ставить какие-либо диагнозы, но не исключает возможности диагностики СД по уровню глюкозы крови [2].
3.2. Лицам с избыточной массой тела и ожирением при наличии одного или более дополнительных факторов риска развития СД2 рекомендуется проведение скрининга нарушений углеводного обмена 1 раз в 3 года, при наличии у пациента с избыточной массой тела или ожирением предиабетических состояний рекомендуется проводить скрининг ежегодно (УДД 3, УУР B).
Комментарии. При отсутствии нарушений углеводного обмена у лиц с избыточной массой тела и ожирением необходимо помнить о необходимости систематического проведения скрининга СД. При превышении ИМТ >25 кг/м 2 и наличии одного дополнительного фактора риска СД2 (табл. 6) скрининг проводится 1 раз в 3 года, в том случае, когда при исследовании глюкозы плазмы натощак/перорального глюкозотолерантного теста (ПГТТ)/ гликированного гемоглобина было выявлено предиабетическое нарушение углеводного обмена, то последующие скрининги проводятся с частотой 1 раз в год [1]. Несмотря на то что исследования, посвященные оценке снижения смертности от проведения скрининга, имеют противоречивые результаты [3, 4], скрининг может способствовать снижению затрат на лечение пациентов с СД2 [5].
Ожирение является одним из ключевых факторов риска развития СД2, для пациентов с СД1 выраженное ожирение нехарактерно, тем не менее, эпидемия ожирения приводит к росту ИМТ и среди больных с СД1 [6]. Поэтому
наличие избыточной массы тела или ожирения у пациента не позволяет исключить диагноз СД1.
Таблица 5. Диагностические критерии сахарного диабета и других нарушений гликемии (ВОЗ, 1999–2013)

Таблица 6. Факторы риска развития сахарного диабета 2 типа
- Возраст ≥45 лет.
- Избыточная масса тела и ожирение (ИМТ ≥25 кг/м 2 ).
- Семейный анамнез СД (родители или сибсы с СД2).
- Привычно низкая физическая активность.
- Нарушенная гликемия натощак или нарушенная толерантность к глюкозе в анамнезе.
- Гестационный СД или рождение крупного плода в анамнезе.
- Артериальная гипертензия (≥140/90 мм рт. ст. или медикаментозная антигипертензивная терапия).
- Холестерин ЛПВП ≤0,9 ммоль/л и/или уровень ТГ ≥2,82 ммоль/л.
- Синдром поликистозных яичников.
- Наличие сердечно-сосудистых заболеваний.
Выбор тактики лечения при ожирении и СД2
3.3. Пациентам с ожирением и сопутствующим СД2 рекомендуется достигать цели по снижению массы тела минимум на 5% исходной в течение 6 мес для улучшения компенсации углеводного обмена (УДД 2, УУР А).
Комментарии. Цель консервативной терапии ожирения как у пациентов с СД2, так и без нарушений углеводного обмена заключается в снижении массы тела на 5–10% исходного веса в течение 6 мес лечения и поддержании достигнутого результата [7]. Изменение образа жизни является основой в лечении ожирения и рекомендуется как первый и постоянный этап лечения ожирения. Анализ результатов исследования Look AHEAD, проведенного среди пациентов с СД2, показал, что снижение веса 5% и более позволило достичь значимого снижения уровня HbA1c, АД, ТГ и увеличения концентрации ЛПВП [8].
Особенности немедикаментозного подхода у пациентов с ожирением при нарушениях углеводного обмена
3.4. Для снижения массы тела пациентам с ожирением и нарушениями углеводного обмена рекомендуется создание условий дефицита суточного потребления энергии за счет снижения суточной калорийности рациона и/или увеличения расхода энергии на 500–700 ккал/сут (УДД 2, УУР А).
Комментарии. На текущий момент не существует доказательной базы, демонстрирующей превосходство того или иного режима питания в снижении и удержании веса. По данным метаанализа 48 клинических исследований с участием 7286 пациентов с избыточной массой тела и ожирением, не было показано преимущества ограничения жиров или углеводов для снижения массы тела [9]. Иными словами, задача диетотерапии сводится к ограничению общей калорийности рациона при соблюдении его сбалансированности. При ожирении без нарушений углеводного обмена одним из ключевых предикторов успеха диетотерапии является приверженность пациента данной диете, а не ограничение определенного вида макронутриентов [10].
3.5. Пациентов с СД1 и с СД2 на болюсной инсулинотерапии рекомендуется обучать правилам подсчета количества углеводов с целью определения дозы болюсного инсулина перед приемами пищи (УДД 1, УУР В).
Комментарии. В том случае, когда пациенту с ожирением и СД2 для достижения целевых значений HbA1c необходимо назначение болюсной инсулинотерапии (инсулинов короткого и ультракороткого действия), важным становится подсчет количества продуктов, содержащих углеводы [11]. При этом стоит задача не полного ограничения углеводов, а строгого контроля их потребления, так как доза инсулина рассчитывается в том числе из расчета съеденных углеводов. Для пациентов, принимающих пероральные сахароснижающие препараты (ПССП) рекомендации по рациону питания схожи с рекомендациями для лиц с ожирением без нарушений углеводного обмена: снижение массы тела у таких пациентов обеспечивает положительный эффект в отношении гликемического контроля, липидного спектра и артериального давления.
3.6. Пациентам с ожирением, СД2 или предиабетическими состояниями рекомендуется средиземноморский тип питания для улучшения контроля гликемии и коррекции факторов риска сердечно-сосудистых заболеваний (УДД 1, УУР А).
Комментарии. Типом питания, положительно влияющим не только на метаболические исходы, но и смертность пациентов с ожирением как при наличии, так и в отсутствие нарушений углеводного обмена, является средиземноморский тип питания. Средиземноморская диета подразумевает достаточное использование оливкового масла, частое употребление растительной пищи (фрукты, овощи, бобовые, злаки, орехи и семена), умеренное потребление вина (особенно красного) с приемами пищи, умеренное потребление рыбы, морепродуктов, ферментированных молочных продуктов (йогурт и сыр), птицы и яиц, редкое потребление красного и обработанного мяса и сладостей [12]. Влияние такого типа питания на сердечно-сосудистые исходы было изучено в исследовании PREDIMED [13]. Среди 7447 включенных пациентов более 90% имели избыточную массу тела и ожирение, около половины страдали СД2. Участники исследования были разделены на 3 группы: 1) средиземноморская диета с добавлением оливкового масла, 2) средиземноморская диета с добавлением орехов, 3) контрольная группа, придерживающаяся низкожировой диеты. Через 4,8 года наблюдения в обеих группах, следовавших средиземноморской диете, наблюдалось снижение риска сердечно-сосудистых исходов (нефатального инфаркта миокарда, нефатального инсульта, сердечно-сосудистой смерти) на 30% по сравнению с контрольной группой. Также пациенты без исходных нарушений углеводного обмена реже заболевали СД2 на средиземноморской диете. Результаты исследования PREDIMED говорят о более благоприятном кардиопротективном эффекте питания с высоким содержанием полиненасыщенных жиров по сравнению с питанием с ограничением жиров. Средиземноморский тип питания рекомендован пациентам с ожирением и СД2 для улучшения сердечно-сосудистого прогноза [14].
3.7. Большинству пациентов с ожирением и СД2 рекомендуется умеренная аэробная физическая активность 3–4 раза в неделю (суммарно не менее 150 мин в неделю) как неотъемлемая часть лечения для поддержания достигнутой в процессе лечения массы тела, контроля гликемии и коррекции факторов риска сердечно-сосудистых заболеваний (УДД 2, УУР В).
Комментарии. Важной составной частью изменения образа жизни является расширение объема физических нагрузок. У лиц с ожирением физическая активность рекомендуется как неотъемлемая часть лечения ожирения и поддержания достигнутой в процессе лечения массы тела. Присоединение к диетотерапии физических нагрузок позволяет достичь ряда неоспоримых преимуществ, таких как увеличение мышечной массы и профилактика саркопенического ожирения.
Основной целью является выполнение аэробной физической активности в течение 150 мин в неделю, что эквивалентно ходьбе со скоростью 5–6 км/ч [15]. Ходьба остается лучшим видом физических нагрузок по многим причинам: не требует специального оборудования, оплаты, места проведения и т.д. Для снижения выраженности висцерального ожирения и увеличения мышечной массы необходимо присоединение анаэробных (силовых) упражнений 3 раза в неделю. Помимо учета времени физической активности, важным компонентом изменения образа жизни является снижение периодов неактивности (сидячего состояния), что достигается благодаря ежедневному выполнению домашних и рабочих дел (уборка, выгуливание домашних животных, подъем по лестнице вместо использования лифта, выход из общественного транспорта за 2–3 остановки раньше и т.п.). Продолжительность непрерывного сидячего положения не должна превышать 1 ч.
3.8. Интенсивная физическая нагрузка не рекомендуется пациентам с ожирением и СД2 с высоким риском гипогликемий, поздними стадиями микрососудистых осложнений СД2, сопутствующими заболеваниями, требующими # ограничения физических нагрузок (УДД 4, УУР С). Рекомендуется временно ограничить физическую нагрузку пациентам с выраженной декомпенсацией углеводного обмена (УДД 4, УУР С).
Комментарии. Сложность быстрого наращивания физической активности у всех лиц с ожирением вне зависимости от наличия нарушений углеводного обмена заключается в том, что для ряда пациентов расширение режима физической активности невозможно в связи с наличием патологии опорно-двигательного аппарата, сердечной или дыхательной недостаточности. Поэтому для лиц с ожирением рекомендовано плавное увеличение физических нагрузок.
У пациентов с ожирением и СД2 имеются особенности интенсификации физической активности. Во-первых, пациенты с СД2 имеют больший риск ИБС, в связи с чем планирование физических нагрузок часто будет требовать предварительного выполнения нагрузочного стресс-теста. Во-вторых, некоторые ПССП и все виды препаратов инсулина повышают риск развития гипогликемий, в связи с чем лица, получающие данные препараты, должны соблюдать меры предосторожности во время выполнения физических нагрузок. Физическая активность способствует снижению гликемии во время и после нагрузок, поэтому основным принципом борьбы с гипогликемиями является их профилактика. При кратковременной нагрузке (до 2 ч) профилактика гипогликемии заключается в дополнительном приеме 10–20 г углеводов при нормальном исходном значении гликемии, при длительных физических нагрузках профилактика гипогликемий осуществляется за счет снижения доз препаратов инсулина накануне и в день активности. Особенную осторожность необходимо соблюдать во время занятий видами спорта, при которых трудно купировать гипогликемию, таких как подводное плавание, дельтапланеризм, серфинг. Таким образом, первостепенным фактором, способным обеспечить безопасность физической активности у пациентов с ожирением и СД2 на препаратах с высоким риском гипогликемий, является запланированность физической нагрузки.
Третья особенность планирования физической активности у лиц с ожирением и наличием СД2 заключается в необходимости учитывать наличие микрососудистых осложнений. Дистальная нейропатия приводит к потере чувствительности и может служить источником травматизма, вегетативная нейропатия опасна риском возникновения ортостатической гипотензии, диабетическая ретинопатия на поздних стадиях при нагрузках высокой интенсивности чревата развитием отслойки сетчатки из-за резкого повышения уровня АД.
Наконец, для пациентов с выраженной декомпенсацией углеводного обмена физическая активность должна быть временно ограничена. В большинстве случаев к временным противопоказаниям к физическим нагрузкам относится стойкое превышение уровня глюкозы плазмы выше 13 ммоль/л в сочетании с кетонурией или выше 16 ммоль/л без кетонурии. Это противопоказание объясняется тем, что в условиях дефицита инсулина физическая активность будет усиливать гипергликемию [1].
Особенности медикаментозной терапии у пациентов с ожирением при нарушениях углеводного обмена.
Лекарственные взаимодействия
3.9. Пациентам с избыточной массой тела и нарушениями углеводного обмена рекомендуется назначать фармакологические препараты для лечения ожирения в сочетании с умеренно гипокалорийной диетой, начиная с ИМТ ≥27 кг/м 2 (УДД 1, УУР А).
Комментарии. Назначение фармакологических препаратов для лечения ожирения рекомендуется в сочетании с умеренно гипокалорийной диетой, начиная с ИМТ ≥30 кг/м 2 или с ИМТ 27 кг/м 2 при наличии ассоциированных с ожирением заболеваний [7].
3.10. Не рекомендуется продолжение приема препаратов для лечения ожирения при отсутствии снижения веса на 5% после 3–4 мес фармакотерапии (УДД 1, УУР А).
Комментарии. Медикаментозная терапия ожирения направлена на ускорение снижения массы тела. По данным исследований, при отсутствии эффекта снижения массы тела на 5% за первые 3–4 мес терапии дальнейшее использование лекарственных препаратов для лечения ожирения не приводило к снижению веса в дальнейшем, поэтому являлось нецелесообразным.
3.11. Пациентам с избыточной массой тела или ожирением и сопутствующим СД2 рекомендуется назначение сахароснижающих препаратов, способствующих снижению массы тела, таких как агонисты рецепторов глюкагоноподобного пептида 1 типа (ГПП-1) и ингибиторы натрий-глюкозных ко-транспортеров 2 типа (иНГЛТ-2) (УДД 2, УУР А).
Комментарии. Согласно российским клиническим рекомендациям по лечению больных СД2 [1], выбор назначаемых сахароснижающих препаратов зависит от доминирующей клинической проблемы: наличия атеросклеротических сердечно-сосудистых заболеваний или факторов риска, сердечной недостаточности, хронической болезни почек (ХБП), ожирения или высокого риска гипогликемий. При сопутствующем СД2 ожирении препаратами выбора будут являться агонисты рецепторов ГПП-1, ингибиторы натрий-глюкозного ко-транспортера 2 типа (иНГЛТ-2), а также метформин. Акарбоза и ингибиторы дипептидилпептидазы (иДПП-4) нейтральны в отношении веса, прибавке массы тела способствует назначение препаратов с высоким риском гипогликемий — производных сульфонилмочевины, препаратов инсулина. Тиазолидиндионы (ТЗД) также приводят к увеличению массы тела.
В клинической практике метформин является стартовым препаратом для лечения пациентов с СД2, он повышает чувствительность периферических рецепторов к инсулину и утилизацию глюкозы клетками. С целью снижения массы тела и контроля гликемии к метформину на втором этапе могут быть добавлены агонисты рецепторов ГПП-1 или иНГЛТ-2. Данные препараты также могут применяться в тройной комбинации.
Важным аспектом, который необходимо учитывать при назначении лекарственной терапии пациентам с СД2, является более высокий риск развития хронической болезни почек (ХБП), чем в общей популяции, в связи с чем требуется оценка функции почек при назначении любого медикамента и последующий ее мониторинг.
3.12. Пациентам с ожирением и СД2, принимающим лекарственную терапию по поводу ожирения, рекомендуется корректировать дозы сахароснижающих препаратов для профилактики гипогликемии (УДД 2, УУР А).
Комментарии. Прием всех препаратов, зарегистрированных для лечения ожирения, может приводить к увеличению чувствительности к инсулину. Совместный прием данной группы препаратов с производными сульфонилмочевины или инсулинами несет повышенный риск развития гипогликемий.
Лираглутид в дозе 3,0 мг в сутки зарегистрирован для лечения ожирения, в дозе до 1,8 мг в сутки — для лечения СД2. В монотерапии лираглутид обладает низким риском гипогликемий благодаря глюкозозависимому действию, однако в комбинациях с другими ПССП имеется риск гипогликемий. При добавлении лираглутида к производным сульфонилмочевины/инсулинам рекомендуется снизить дозу последних с последующим контролем гликемии.
Хирургическое лечение пациентов с ожирением и СД2
3.13. Метаболическая хирургия рекомендуется для лечения СД2 у взрослых пациентов с ИМТ ≥35 кг/м 2 (≥32,5 кг/м 2 для азиатской популяции), не достигших контроля гликемии после нескольких попыток нехирургического лечения ожирения (изменения образа жизни и медикаментозной терапии). Метаболическая хирургия может рассматриваться у лиц с ИМТ ≥30 кг/м2 (≥27,5 кг/м2 для азиатской популяции), не достигших снижения массы тела и контроля гликемии на фоне нехирургического лечения (УДД 1, УУР А).
Комментарии. Показания к хирургическому лечению пациентов с ожирением возникают при неэффективности немедикаментозных и фармакологических методов лечения. У пациентов с ожирением принято использовать термин «бариатрические вмешательства», у пациентов с метаболическими осложнениями, в первую очередь при СД2 — «метаболические вмешательства».
Для пациентов с ожирением показанием к выполнению бариатрических операций является ИМТ более 40 кг/м 2 . При наличии СД2 пациенту может быть рекомендована метаболическая операция при меньшей выраженности ожирения, начиная с ИМТ более 35 кг/м 2 . У ряда пациентов возможно рассмотреть хирургический метод лечения при ИМТ ≥30 кг/м 2 .
Российские рекомендации согласуются с международными данными, в которых решение о переходе к хирургическому этапу лечения СД2 основывается не только на величине ИМТ, но и на возможности достижения компенсации углеводного обмена в предыдущие этапы лечения [16].
При выборе оперативного вмешательства у пациентов с ожирением и нарушениями углеводного обмена следует полагаться на частоту достижения компенсации углеводного обмена после той или иной операции. Более выраженным сахароснижающим эффектом обладают шунтирующие операции, менее выраженным — рестриктивные. Вероятность компенсации углеводного обмена в послеоперационном периоде преимущественно зависит от длительности СД2, количества сахароснижающих препаратов, получения инсулинотерапии и качества дооперационного контроля гликемии [17].
3.14. В послеоперационном периоде пациентам рекомендуется частый контроль гликемии с коррекцией доз сахароснижающих препаратов для снижения риска развития гипогликемии (УДД 3, УУР В).
Комментарии. В раннем послеоперационном периоде рекомендуется частый мониторинг гликемии (не менее 2 раз в день) для решения вопроса о коррекции сахароснижающей терапии [18]. При возникновении гипогликемии на фоне исходной сахароснижающей терапии рекомендуется постепенная отмена препаратов. Потребность в самоконтроле гликемии у пациентов после метаболического вмешательства остается длительно, частота самоконтроля индивидуальна и зависит от типа сахароснижающих препаратов и темпов снижения массы тела.
3.15. Хирургическое лечение СД1 не рекомендовано, за исключением пациентов с ИМТ ≥40 кг/м 2 (УДД 1, УУР А).
Комментарии. Метаболическая хирургия не показана пациентам с СД1, так как она не воздействует на патогенез данного заболевания. Однако у пациентов с ИМТ> 40 кг/м 2 эффект метаболической хирургии может проявлять в снижении доз инсулинотерапии, а также в коррекции других метаболических заболеваний [19].
СПИСОК ЛИТЕРАТУРЫ | REFERENCES
1. Дедов И.И., Шестакова М.В., Майоров А.Ю. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом: Клинические рекомендации (Вып. 9) // Сахарный диабет. — 2019. — Т. 22. — №S1. — С. 1-144. [Dedov II, Shestakova MV, Mayorov AYu et al. Standards of specialized diabetes care. Diabetes Mellitus. 2019,22(S1):1-144 (In Russ.)]. doi: https://doi.org/10.14341/DM221S1
2. Gabir MM, Hanson RL, Dabelea D, et al. The 1997 American Diabetes Association and 1999 World Health Organization criteria for hyperglycemia in the diagnosis and prediction of diabetes. Diabetes Care. 2000,23(8):1108-1112. doi: https://doi.org/10.2337/diacare.23.8.1108
3. Simmons RK, Griffin SJ, Witte DR et al. Effect of population screening for type 2 diabetes and cardiovascular risk factors on mortality rate and cardiovascular events: a controlled trial among 1,912,392 Danish adults. Diabetologia. 2017,60(11):2183-2191. doi: https://doi.org/10.1007/s00125-017-4323-2
4. Simmons RK, Griffin SJ, Lauritzen T, Sandbæk A. Effect of screening for type 2 diabetes on risk of cardiovascular disease and mortality: a controlled trial among 139,075 individuals diagnosed with diabetes in Denmark between 2001 and 2009. Diabetologia. 2017,60(11):2192-2199. doi: https://doi.org/10.1007/s00125-017-4299-y
5. Sortsø C, Komkova A, Sandbæk A, et al. Effect of screening for type 2 diabetes on healthcare costs: a register-based study among 139,075 individuals diagnosed with diabetes in Denmark between 2001 and 2009. Diabetologia. 2018,61:1306. doi: https://doi.org/10.1007/s00125-018-4594-2
6. Mottalib A, Kasetty M, Mar JY, et al. Weight Management in Patients with Type 1 Diabetes and Obesity. Curr Diab Rep. 2017,17:92. doi: https://doi.org/10.1007/s11892-017-0918-8
7. Дедов И.И., Мельниченко Г.А., Шестакова М.В., и др. Лечение морбидного ожирения у взрослых // Ожирение и метаболизм. — 2018. — Т. 15. — №1. — С. 53-70. [Dedov II, Mel’nichenko GA, Shestakova MV, et al. Russian national clinical recommendations for morbid obesity treatment in adults. 3rd revision (Morbid obesity treatment in adults). Obesity and metabolism. 2018,15(1):53-70. (In Russ.)]. doi: https://doi.org/10.14341/omet2018153-70
8. Wing RR, Lang W, Wadden TA, et al. Benefits of Modest Weight Loss in Improving Cardiovascular Risk Factors in Overweight and Obese Individuals With Type 2 Diabetes. Diabetes Care. 2011,34(7):1481-1486. doi: https://doi.org/10.2337/dc10-2415
9. Johnston BC, Kanters S, Bandayrel K, et al. Comparison of Weight Loss Among Named Diet Programs in Overweight and Obese Adults. A Meta-analysis. JAMA. 2014,312(9):923-933. doi: https://doi.org/10.1001/jama.2014.10397
10. Sacks FM, Bray GA, Carey VJ, et al. Comparison of Weight-Loss Diets with Different Compositions of Fat, Protein, and Carbohydrates. N Engl J Med. 2009,360(9):859-873. doi: https://doi.org/10.1056/NEJMoa0804748
11. Bell KJ, Barclay AW, Petocz P, et al. Efficacy of carbohydrate counting in type 1 diabetes: a systematic review and metaanalysis. Lancet Diabetes Endocrinol. 2014,2(2):133-140. doi: https://doi.org/10.1016/S2213-8587(13)70144-X
12. D’Alessandro A, De Pergola G. Mediterranean Diet Pyramid: A Proposal for Italian People. Nutrients. 2014,6:4302-4316. doi: https://doi.org/10.3390/nu6104302.
13. Estruch R, Ros E, Salas-Salvadó J, et al. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. N Engl J Med. 2018,378(25):e34. doi: https://doi.org/10.1056/NEJMoa1800389
14. Esposito K, Maiorino MI, Bellastella G, et al. A journey into a Mediterranean diet and type 2 diabetes: a systematic review with meta-analyses. BMJ Open. 2015,5(8):e008222. doi: https://doi.org/10.1136/bmjopen-2015-008222
15. Durrer Schutz D, Busetto L, Dicker D, et al. European Practical and Patient-Centred Guidelines for Adult Obesity Management in Primary Care. Obes Facts. 2019,12(1):40-66. doi: https://doi.org/10.1159/000496183
16. Rubino F, Nathan DM, Eckel RH, et al. Metabolic Surgery in the Treatment Algorithm for Type 2 Diabetes: A Joint Statement by International Diabetes Organizations. Diabetes Care. 2016,39(6):861-877. doi: https://doi.org/10.2337/dc16-0236
17. Aminian A, Brethauer SA, Andalib A? et al. Individualized Metabolic Surgery Score: Procedure Selection Based on Diabetes Severity. Ann Surg. 2017,266(4):650-657. doi: https://doi.org/10.1097/SLA.0000000000002407
18. Busetto L, Dicker D, Azran C, et al. Practical Recommendations of the Obesity Management Task Force of the European Association for the Study of Obesity for the Post-Bariatric Surgery Medical Management. Obes Facts. 2017,10(6):597-632. doi: https://doi.org/10.1159/000481825
19. Hussain A. The effect of metabolic surgery on type 1 diabetes: meta-analysis. Arch Endocrinol Metab. 2018,62(2):172-178. doi: https://doi.org/10.20945/2359-3997000000021
ГЛАВА 4. ОЖИРЕНИЕ И РЕПРОДУКТИВНОЕ ЗДОРОВЬЕ ЖЕНЩИНЫ
Андреева Е.Н., Шереметьева Е.В.
ЭПИДЕМИОЛОГИЯ
Количество женщин c ожирением в возрасте старше 18 лет в России, по данным ВОЗ, составляет 31% [1].
ВЛИЯНИЕ ОЖИРЕНИЯ НА РЕПРОДУКТИВНОЕ ЗДОРОВЬЕ ЖЕНЩИНЫ
Ожирение оказывает отрицательное влияние на гипоталамо-гипофизарно-яичниковую ось, нарушает ритм и соотношение гонадотропных гормонов, снижает интенсивность фолликулогенеза и провоцирует снижение уровня прогестерона [2–7].
Ожирение и регулярность менструального цикла
4.1. Рекомендовано всем женщинам в репродуктивном периоде с избыточной массой тела или ожирением оценивать регулярность менструального цикла (например, по данным менструального календаря, который ведет сама женщина) (УУР А, УДД 3) [8–14].
Комментарии. Нарушения менструального цикла встречаются чаще у женщин с ожирением и прогрессируют (вплоть до аменореи) по мере увеличения ИМТ [7, 8]. Однако следует помнить о женщинах с высоким ИМТ, у которых менструальные циклы овуляторные, но с течением времени и при некомпенсации ожирения фертильность пациентки будет снижаться. Риск развитии нарушений менструального цикла зависит не только от ИМТ, но и от величины ОТ. Женщины репродуктивного возраста с ОТ более 80 см чаще имеют синдром хронической ановуляции в сравнении с теми, у которых такой же ИМТ, но ОТ менее 80 см [9, 10].
4.2. Для диагностики избыточной массы тела и ожирения (и оценки его степени) всем женщинам репродуктивного периода на этапе прегравидарной подготовки рекомендовано определение ИМТ (УУР А, УДД 3) [15–18].
Комментарии. Повышенный ИМТ у матери может быть фактором риска патологического течения беременности.
Ожирение у женщины репродуктивного возраста является фактором риска потери беременности на малом сроке [17, 18]. Ожирение у матери до беременности увеличивает как общую, так и тяжелую материнскую заболеваемость во время беременности [17]. Повышенный ИМТ у матери может быть фактором риска патологического течения беременности. Высокий риск типичных акушерских осложнений при ожирении:
- угрожающий выкидыш (в 2,5 раза чаще у беременных с ожирением, чем у здоровых беременных женщин),
- замершая беременность,
- преждевременные роды,
- гестационный диабет,
- макросомия плода,
- задержка роста плода,
- преэклампсия,
- эклампсия,
- гипогалактия.
Беременные с ожирением чаще нуждаются в абдоминальном родоразрешении и применении оперативных пособий[17, 18].
У женщин с ожирением риск рождения ребенка с макросомией или врожденной аномалией развития повышен. Тяжелые перинатальные исходы чаще встречаются в группе женщин с ожирением, чем с нормальной массой тела (табл. 7) [19, 20].
Таблица 7. Антенатальные потери, мертворождение, перинатальные и неонатальные потери, младенческая смертность в зависимости от ИМТ матери
ИМТ до беременности, кг/м 2
"