Дифференциальная диагностика инциденталом надпочечников | Молашенко | Ожирение и метаболизм
Дифференциальная диагностика инциденталом надпочечников
В лекции представлен современный алгоритм обследования пациентов с инциденталомой надпочечников, рассмотрены основные принципы лабораторной, инструментальной диагностики и параметры динамического наблюдения.
Ключевые слова
Для цитирования:
Молашенко Н.В., Платонова Н.М., Бельцевич Д.Г., Юкина М.Ю., Трошина Е.А. Дифференциальная диагностика инциденталом надпочечников. Ожирение и метаболизм. 2016,13(4):39-44. https://doi.org/10.14341/omet2016439-44
For citation:
Molashenko N.V., Platonova N.M., Beltsevich D.G., Yukina M.Yu., Troshina E.A. Diagnosis and differential diagnosis of adrenal incidentalomas. Obesity and metabolism. 2016,13(4):39-44. (In Russ.) https://doi.org/10.14341/omet2016439-44
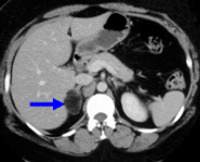
Инциденталома надпочечника – случайно выявленное объемное образование надпочечника, требующее нозологической конкретизации. Термин «инциденталома» надпочечника является собирательным, включающим разнообразную по морфологии группу опухолей более 1 см в диаметре, случайно выявленных при радиологическом обследовании. Выявленное образование может:
- оказаться как гормонально-неактивным, так и активно производить различные гормоны,
- исходить из различных зон надпочечника или иметь неспецифичную органную принадлежность,
- быть злокачественным или доброкачественным.
«Эпидемия» инциденталом надпочечника напрямую связана с широким распространением и использованием ультразвукового исследования (УЗИ), компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ).
По данным сводной аутопсийной статистики распространенность случайно выявленных опухолей надпочечника составляет в среднем 6%. По данным КТ «случайные» образования надпочечника выявляются приблизительно у 4% обследованных пациентов. В возрасте до 30 лет инциденталома встречается приблизительно у 0,2% обследованных, но в группе пациентов старше 70 лет частота возрастает до 7% (табл.1).
Таблица 1. Эпидемиологическая встречаемость различного типа опухолей при случайном их выявлении (сводные данные литературы), %
Гормонально-активные аденомы (субклинический гиперкортицизм)
Ганглионейрома, нейробластома, шваннома
Липома, лейомиома/саркома, паразитарная киста (эхинококк), гемангиома, гамартома, гематома, тератома, гранулема различной этиологии, псевдонадпочечниковые образования (исходящие из других органов)
- При выявлении опухоли надпочечника размером более 1 см в первую очередь рекомендовано исключение/подтверждение гормональной активности образования, которая может проявляться гиперкатехоламинемией, эндогенным гиперкортицизмом (ЭГ), первичным гиперальдостеронизмом.
- Лабораторная диагностика состоит из 2 этапов: в качестве первичного исследования выбирается тест, обладающий наибольшей чувствительностью в отношении определенного спектра синтезируемых гормонов. Если первичный высокочувствительный тест отрицает гормональную опухолевую активность, необходимости во втором этапе гормональных исследований нет. Если же первичный тест выявил гормональную активность или получены сомнительные результаты, необходимо подтверждение автономной опухолевой активности при помощи высокоспецифичного теста.
Эндогенный гиперкортицизм (ЭГ)
- Всем пациентам с выявленной опухолью надпочечника рекомендовано определение кортизола в ранние утренние часы на фоне подавляющего теста с 1 мг дексаметазона (ПТД). Недооценка наличия гиперкортицизма (манифестного или субклинического) связана с высоким риском развития острой надпочечниковой недостаточности в послеоперационном периоде.
- При отсутствии физиологического подавления уровня кортизола в ходе ПТД в качестве подтверждающего теста для диагностики кортизолпродуцирующей опухоли надпочечника предлагается использовать определение адренокортикотропного гормона (АКТГ) в утренние часы.
Пациенты с инциденталомой надпочечника редко имеют развернутую клиническую картину гиперкортицизма. Однако биохимические признаки субклинического гиперкортицизма отмечаются примерно у 10% больных.
Наиболее удобным и чувствительным тестом при ЭГ, включая субклинический ЭГ, признан ночной подавляющий тест с 1 мг дексаметазона. У здоровых лиц после приема препарата происходит подавление АКТГ и синтеза кортизола. При назначении низких доз синтетического глюкокортикоида дексаметазона при синдроме эндогенного гиперкортицизма любого генеза этого подавления не происходит. Ночной тест достаточно прост и выполним в амбулаторных условиях: 1 мг дексаметазона принимается между 23 и 24 часами, кортизол измеряется в крови, взятой следующим утром между 8 и 9 часами. Более высокие дозы дексаметазона (1,5 или 2 мг) не улучшают точность теста. В таблицах 2, 3 представлены заболевания/состояния, а также влияние лекарственных средств, которые могут отразиться на результатах ПТД.
Таблица 2. Подтверждающие эндогенный гиперкортицизм тесты, применяемые в особых клинических случаях
Используемые методы исследования для диагностики эндогенного гиперкортицизма
Суточный анализ мочи на св. кортизол – в 1-м триместре остается в норме, повышается во 2-м и 3-м триместре, однако повышение показателя более чем в 3 раза от верхней границы нормы подтверждает диагноз. ПТД не проводится (ложноположительные результаты)
Определение показателей вечернего кортизола слюны, крови, св. кортизола в суточной моче. ПТД не проводится – прием противосудорожных препаратов приводит к ложноположительным результатам, отмена этих препаратов невозможна по жизненным показаниям
Предпочтительнее ПТД – подавление кортизола на пробе исключает диагноз, однако отсутствие снижения кортизола в ходе пробы достоверно подтвердить диагноз не может. Нормальные показатели вечернего кортизола слюны также делают диагноз маловероятным. Анализ св. кортизола в суточной моче не информативен – содержание кортизола в моче снижается при снижении клиренса креатинина до 60 мл/мин, значительно уменьшается при 20 мл/мин
Таблица 3. Лекарственные препараты, влияющие на показатели кортизола крови и изменяющие результаты фармакологических тестов, проводимых для диагностики эндогенного гиперкортицизма
Препараты, ускоряющие метаболизм дексаметазона за счет индукции фермента CYP3A4 печени
Фенобарбитал, фенитоин, карбамазепин, рифапин, рифампицин, этосуксимид, пиоглитазон
Препараты, замедляющие метаболизм дексаметазона за счет снижения активности фермента печени CYP3A4
Итраконазол, ритонавир, флуоксетин, дилтиазем, циметидин
Препараты, повышающие уровень кортизолсвязывающего глобулина (ложноположительное повышение кортизола крови)
В качестве диагностического критерия ЭГ предложено считать отсутствие подавления утреннего кортизола в ходе ПТД менее 50 нмоль/л (чувствительность более 95%).
При инциденталомах надпочечников определение суточного кортизола мочи обладает меньшей чувствительностью в сравнении с ПТД и вечерним кортизолом в слюне. В качестве теста, верифицирующего тип ЭГ, рекомендовано определение в утренние часы уровня АКТГ. Подавленный уровень АКТГ (менее 10 пг/мл) подтверждает диагноз синдрома Иценко-Кушинга (кортизолпродуцирующей опухоли надпочечника).
Если при манифестном синдроме Иценко-Кушинга оперативное лечение – это метод выбора, то при субклиническим варианте синдрома (отсутствие подавления кортизола в ходе ночного ПТД при нормальных показателях кортизола в суточной моче и вечернего кортизола слюны), выбрать метод лечения сложнее. Показания к операции, опирающиеся исключительно на диагноз субклинического гиперкортицизма при доброкачественных опухолях надпочечника, дискутируются. «ЗА» операцию – молодой возраст больного, возможное отрицательное влияние субклинического гиперкортицизма на существующие у больного артериальную гипертензию, остеопороз, нарушения углеводного обмена, ожирение. «ПРОТИВ» – пожилой возраст, отсутствие заболеваний, в генезе которых может участвовать гиперкортицизм, развитие послеоперационной надпочечниковой недостаточности.
Возникновение послеоперационной острой надпочечниковой недостаточности является основной причиной, из-за которой диагностика субклинического гиперкортицизма является строго обязательной. Клинические проявления являются неспецифическими для послеоперационного периода и часто схожи с другими осложнениями (кровотечение, интоксикация, острый инфаркт миокарда и т.д.): отсутствие аппетита, слабость, тошнота, умеренная гипотония, вздутие живота, вечерние гектические подъемы температуры. Несвоевременно распознанные и некупированные клинические проявления могут привести к фатальному исходу.
Опухоль коры надпочечника, автономно продуцирующая кортизол, является причиной атрофии коры контралатерального надпочечника. При длительном течении гиперкортицизма возможна необратимая атрофия коры НП, требующая длительной, если не пожизненной, заместительной терапии глюкокортикоидами после оперативного лечения.
- Недооценка наличия катехоламинсекретирующей опухоли связана с высоким риском периоперационного развития высокоамплитудных гипертензивных кризов, отека легких, фатальных аритмий, синдрома «неуправляемой гемодинамики» и внезапной сердечной смерти. Даже если клиническое течение ФХЦ/ПГ было «бессимптомным», высокий уровень циркулирующих катехоламинов во время операции приводит к гипертензивным кризам, аритмиям, синдрому «неуправляемой гемодинамики». К серьезным лечебным ошибкам приводит недооценка гиповолемического синдрома у больных с ФХЦ/ПГ.
Длительное бессимптомное течение ФХЦ/ПГ может быть объяснено внутриопухолевым метилированием активных фракций катехоламинов ферментом катехоламин-О-метилтрансферазой (КОМТ). Однако, во время оперативного вмешательства, при механическом давлении на опухоль или под влиянием фармакологических препаратов, интраоперационный выброс активных фракций катехоламинов может обуславливать дебютную симптоматику ФХЦ/ПГ. В связи с этим всем пациентам с биохимически подтвержденной ФХЦ/ПГ необходимо проводить предоперационную подготовку блокаторами α-адренорецепторов (доксазозин), целью которой является нивелирование воздействия циркулирующих катехоламинов на адренорецепторы.
- В качестве метода первичной диагностики ФХЦ/ПГ рекомендовано определение свободных метанефринов плазмы или фракционированных метанефринов суточной мочи. Наибольшей диагностической точностью в определении метилированных производных катехоламинов (метанефрина, норметанефрина и метокситирамина) в биологических жидкостях обладает метод жидкостной хроматографии с масс-спектрометрией или электрохимический анализ. Забор крови для определения уровня метанефринов рекомендовано проводить в положении лежа после 30-минутного горизонтального положения. Всем пациентам с положительным результатом тестирования необходимо углубленное обследование для исключения или подтверждения ФХЦ/ПГ.
Исследования в отношении фракционированных метанефринов продемонстрировали высокие показатели чувствительности и отрицательной прогностической ценности (т.е. доли правильных отрицательных результатов диагностического теста) при ФХЦ/ПГ, близкие к абсолютным значениям (96–99%). Существенной проблемой интерпретации положительного результата теста на фракционированные метанефрины являются невысокие показатели (т.н. «серая зона»), в которые попадают и четверть пациентов с ФХЦ/ПГ, и, в гораздо большей степени, пациенты без опухоли или с опухолью надпочечника иного происхождения. В большинстве случаев причиной ложноположительного результата является нарушение техники проведения исследования или влияния лекарственных препаратов (табл. 4), что требует повторного определения показателей.
Таблица 4. Влияние лекарственных препаратов на показатели фракционированных метанефринов
Препарат, группа препаратов