Диагностика и терапия аденом гипофиза | Бейлерли | Креативная хирургия и онкология
Диагностика и терапия аденом гипофиза
Аденомы гипофиза являются одними из наиболее распространенных первичных внутричерепных опухолей.
Обычно доброкачественные, на их долю приходится 10–15 % всех внутричерепных новообразований. Подразделяются на 2 подгруппы: макроаденомы (>1 см) и микроаденомы (
Ключевые слова
Для цитирования:
Бейлерли О.А., Shiguang Z., Гареев И.Ф., Xin C. Диагностика и терапия аденом гипофиза. Креативная хирургия и онкология. 2019,9(4):311-316. https://doi.org/10.24060/2076-3093-2019-9-4-311-316
For citation:
Beylerli O.A., Shiguang Z., Gareev I.F., Xin C. Diagnosis and Treatment of Pituitary Adenomas. Creative surgery and oncology. 2019,9(4):311-316. (In Russ.) https://doi.org/10.24060/2076-3093-2019-9-4-311-316
Введение
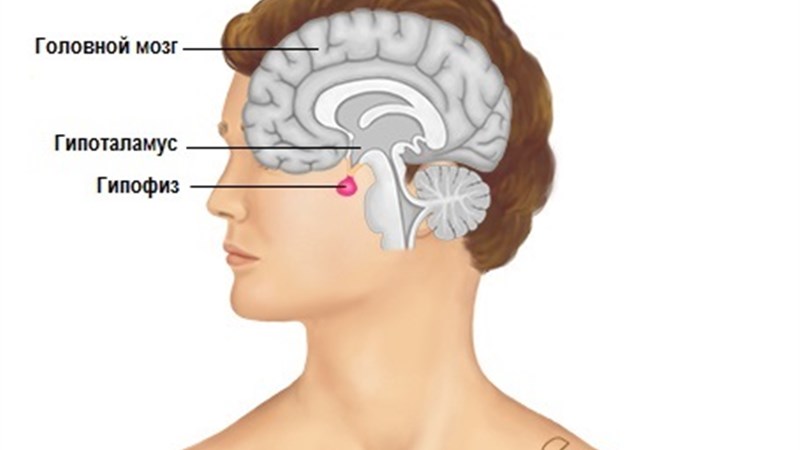
Аденомы гипофиза представляют собой доброкачественные новообразования передней доли гипофиза, на которые приходится 10-15 % всех внутричерепных опухолей [1]. Таким образом, они являются одними из наиболее распространенных первичных внутричерепных опухолей. Некоторые из этих новообразований являются локально инвазивными. Только очень небольшая часть (0,1-0,2 %) также показывает признаки злокачественности. К 30 годам от аденомы гипофиза лечатся больше женщины. Однако в более старшем возрасте аденома гипофиза чаще встречается у мужчин [2]. Возможным объяснением этого является то, что такие симптомы, как аменорея или галакторея, чаще становятся причиной диагноза у молодых женщин. В аденомах гипофиза необходимо проводить различие между гормон-продуцирующими и гормон-неактивными опухолями. Кроме того, аденомы гипофиза подразделяются на макроаденомы (>1 см) и микроаденомы (4 см. В этих случаях говорят о «гигантских аденомах». Это может быть локальное сдавление в области гипоталамуса, окклюзия спинномозговой жидкости в области III желудочка, что приводит к гидроцефалии.
Гормон-продуцирующая форма
В зависимости от линии клеток, из которой они произошли, опухоли могут продуцировать и секретировать все гормоны аденогипофиза, что может привести к метаболическим заболеваниям. Чаще всего (30-50 % аденом гипофиза) пролактин вырабатывается аденомами гипофиза [3, 4]. Избыток пролактина вызывает гипогонадизм путем подавления секреции гонадотропина. Это проявляется в потере либидо у женщин с галактореей и аменореей и у мужчин с нарушением потенции. Вторым наиболее распространенным гормоном, на который может влиять гиперсекреция, вызванная аденомой, является соматотропин. Около 10-15 % аденом гипофиза выделяют гормон роста [3, 4]. В детстве это проявляется через избыточный рост, а во взрослой жизни — через акромегалию. Типичные акромегалические стигматы включают увеличение носа, губ, гипертрофию лица, щек и подбородка, включая макроглоссию, увеличение рук и ног и внутренних органов. Пациенты часто страдают синдромом обструктивного апноэ во сне, артериальной гипертензией, сахарным диабетом, болями в суставах и гипергидрозом. Без лечения гипертрофическая кардиомиопатия может привести к летальным осложнениям в течение нескольких лет. Симптомы болезни Кушинга (5 % аденом гипофиза) вызваны аденомой с гиперсекрецией адренокортикотропного гормона (АКТГ), что впоследствии приводит к центральной гиперсекреции кортизола в коре надпочечников [3, 4]. Наблюдается типичная эритема и атрофия с образованием бороздок. Артериальная гипертензия, сахарный диабет, остеопороз, мышечная атрофия являются наиболее важными сопутствующими факторами, которые существенно влияют на течение заболевания. Очень редко (
Гормон-неактивная форма
Около 30 % аденом гипофиза не продуцируют гормоны [5]. Эти опухоли обычно симптоматичны по массе. В большинстве случаев это сжатие chiasma opticum, которое может привести к нарушениям зрения с патогномоничной битемпоральной гемианопсией. Недостаточность аденогипофиза часто выявляется только при эндокринологической диагностике. Гораздо реже сдавление кавернозного синуса может привести к сбоям черепных нервов III, IV, V и VI.
Дифференциальная диагностика
В то время как аденомы гипофиза, безусловно, являются наиболее распространенными внутриклеточными опухолями, существует ряд диагнозов, которые необходимо учитывать. Для кистозных, чисто интраселлярных поражений, можно рассмотреть кисту из мешка Ратке и коллоидную кисту. В редких случаях в этой области диагностируется дермоид или эпидермоид [6]. Краниофарингиомы встречаются как в кистозной, так и в твердой формах [7]. Типичной локализацией для краниофарингиом является супраселлярная, с контактом со стеблем гипофиза. Расширение опухоли в III желудок или пара- и ретроселлярную области встречаются гораздо чаще, чем аденомы гипофиза. Чрезвычайно редким является рак гипофиза (~0,1 % аденом гипофиза), который характеризуется метастазированием. Тем не менее более распространенной группой опухолей, которые могут быть четко отделены морфологически от аденом гипофиза, являются менингиомы, хордомы и хондросаркомы. Хотя эти опухоли также встречаются в непосредственной близости от Sella turcica, они обычно имеют специфическую схему роста и приводят к изменениям в гипофизе, только позже.
Диагностическое обследование
Диагностическая оценка аденом гипофиза сложна и требует междисциплинарного сотрудничества неврологов, нейрохирургов, эндокринологов, офтальмологов и рентгенологов. Инвазивные опухоли также требуют привлечения ЛОР-специалистов.
Физическое обследование
Если имеется подозрение на аденому гипофиза, пациенты должны быть тщательно проверены на наличие потенциальных симптомов. Это включает в себя неврологическое обследование с особым вниманием к остроте зрения и глазодвигательной системе, поскольку опухоли могут вызывать симптомы сдавления зрительного хиазма, зрительного нерва или нервов глазной мышцы, которые пациент не воспринимает. Для очень больших опухолей (гигантская аденома) будут характерны симптомы нарушения функций гипоталамуса и лимбической системы.
Лучевая диагностика
Визуализация формирует центральную опору диагностики различных патологических изменений в гипофизе. Магнитно-резонансная томография (МРТ) является методом выбора. Тонкопленочные рентгенограммы Sella turcica в коронарном и сагиттальном направлениях срезов в T2 и Tl, проведенные с контрастными веществами и без них, обеспечивают лучшую диагностическую селективность и должны быть включены в любое исследование МРТ при гипофизарных процессах.
Офтальмологическое обследование
Периметрия и визуализация у офтальмолога являются частью любого исследования аденомы гипофиза. В случае ненормальных результатов следует искать декомпрессию.
Эндокринологическая диагностика
Исследование эндокринной функции аденогипофиза должно начинаться с терапии изменений гипофиза. Сначала определяются уровни базальных гормонов гипофиза. К ним относятся пролактин (ПРЛ), АКТГ с кортизолом, соматотропный гормон (СТГ) с инсулиноподобным фактором роста-1 (ИФР-1), ТТГ и ЛГ, фолликулостимулирующий гормон (ФСГ) и эстрадиол. Выраженная гипофункция может быть обнаружена уже в этом исследовании. Наличие выраженной гиперпролактинемии с ПРЛ более чем в 5 раз выше верхнего контрольного предела указывает на наличие пролактиномы. Однако исключение гормональной избыточной или недостаточной функции может быть сделано только с помощью тестов стимуляции или подавления. Если обнаружена патологическая секреция СТГ, АКТГ или ТТГ, наряду с обнаружением изменений гипофиза на МРТ, есть показания к хирургическому вмешательству.
Терапия
Консервативный подход
Консервативная терапия доступна только при пролактиноме. Даже при очень больших опухолях небольшая доза агонистов дофамина в течение короткого времени может привести к заметному уменьшению объема опухоли. Агонисты дофамина являются препаратом первой линии для лечения пролактином. Но одним из недостатков является то, что лечение должно проводиться в течение нескольких лет или до конца жизни [8]. Хотя терапия имеет мало побочных эффектов, она переносится не всеми пациентами. Около 10 % пациентов не реагируют на лечение даже при высоких дозах агонистов дофамина [9]. Этим пациентам показано хирургическое лечение. Медикаментозная терапия при акромегалии и болезни Кушинга с целью нормализации гормонального баланса играет второстепенную роль в первичной терапии, но используется в резистентных к терапии случаях.
Оперативное вмешательство
Хирургия — это лечение выбора для всех симптоматических аденом гипофиза, кроме пролактином. В случае прогрессирования размера, когда возникают эндокринологические или офтальмологические симптомы, показана операция. Для более крупных бессимптомных опухолей в контакте или смещении от зрительного хиазма показана операция. На этом этапе необходимо тесное междисциплинарное сотрудничество.
Резекция аденомы гипофиза происходит через трансназальный транссфеноидальный доступ. Только в редких гигантских аденомах с над- и параселлярным ростом иногда указывается транскраниальный доступ. Транссфеноидальный подход к гипофизу впервые был выполнен в 1907 году Германом Шлоффом [10]. С момента появления микрохирургической технологии для освещения и увеличения использовался хирургический микроскоп. В последние два десятилетия эндоскоп становится все более популярным в хирургии гипофиза [11]. Эндоскопическая техника обеспечивает панорамный обзор клиновидной пазухи, что значительно упрощает оценку сложных анатомических условий. Кроме того, использование эндоскопа позволяет расширить трансназальный доступ к средней линии основания черепа. При лечении классических аденом гипофиза эти две методики в настоящее время считаются эквивалентными. Тем не менее в литературе есть некоторые доказательства того, что эндоскопическая техника может выиграть от лучшей визуализации и раннего выявления дисфункции гипофиза [12].
В дополнение к различным хирургическим методам все чаще в хирургии гипофиза используется интраоперационная компьютерная навигация. В связи с этим важную роль играет интраоперационная МРТ (иМРТ). При использовании микрохирургической технологии иMRT может компенсировать отсутствие ясности и значительно увеличить степень резекции [12, 13]. В то же время резектируемые остатки опухоли можно удалить с эндоскопической техникой в сочетании с иMRT, чтобы распознавать инвазивные аденомы гипофиза и увеличивать частоту полных резекций аденомы [12, 13]. В результате выживание без прогрессирования может быть значительно продлено [14].
К интраоперационным методам визуализации также относится флуоресценция с индоцианином зеленым [15]. Во время операции клиновидная пазуха сначала открывается через клиновидную впадину и устье. В зависимости от требуемого размера доступа этот шаг может быть выполнен с обеих сторон и межсфеноидная перегородка может быть удалена. Доступ к клиновидной пазухе через заднюю решетчатую кость также возможен, но требуется только во время обширной операции. При данном доступе со слизистой оболочкой носа следует контактировать как можно осторожнее, чтобы предотвратить возможные послеоперационные симптомы из-за нарушения мукоцилиарного клиренса (инкрустация, заложенность носа, синусит). При рецидивах и более крупных дефектах может потребоваться реконструкция основания черепа с помощью слизистой оболочки носа [16].
После вскрытия клиновидной пазухи открывается мозговая оболочка. Здесь использование интраоперационной навигации может облегчить ориентацию и помочь лучше определить пределы резекции. Ткань аденомы обычно очень мягкая и хорошо отличается от соседних структур.
При опухолях без инвазии в кавернозный синус полная резекция опухоли может быть достигнута более чем в 80 % случаев [12]. Однако опухоль нередко проникает в кавернозный синус, клиновидную пазуху или внутричерепную диафрагму через диафрагму спинки турецкого седла. Тогда резекция становится значительно более сложной, а резектабельность снижается. Частота полных резекций снижается до
Радиотерапия
В случае первичной терапии аденомы гипофиза лучевая терапия показана только в исключительных случаях. Основным показанием для лучевой терапии в виде стереотаксического однократного облучения является прежде всего лечение нерезектабельных остатков опухоли или рецидива опухоли. Доза 15-25 Гр вводится за один сеанс. При этой дозе локальный контроль опухоли достигается более чем в 90 % случаев через 5 лет [18]. Ограничивающими дозу структурами являются зрительный хиазм и зрительный нерв. Тщательное планирование может снизить частоту повреждения зрительного нерва, вызванного терапией, до максимум 4 % случаев. Возникновение недостаточности передней доли гипофиза также зависит от дозы и увеличивается от >11 Гр до 51 % через 5 лет [19].
Осложнения
Одним из наиболее распространенных осложнений является риноликворея. Согласно современным исследованиям, заболеваемость составляет от 2 до 6 % [20, 21]. Текущие исследования не показывают повышенного риска ликвореи, связанного с эндоскопической техникой [12, 22]. В то же время инфекционные осложнения в результате инвазии встречаются редко. Риск составляет 0,4-3,7 % [20, 22, 23]. Транссфеноидальная декомпрессия зрительного хиазма является успешной в большинстве случаев независимо от используемой методики. В настоящем анализе операций степень коррекции зрения достигла почти 70 % [24, 25]. Следующая важная цель — послеоперационное сохранение функции гипофиза. Риск новой послеоперационной недостаточности передней доли гипофиза в настоящее время составляет от 6 до 15 % [22, 26, 27]. Размер аденомы и инвазивность являются важными прогностическими факторами, которые способствуют возникновению послеоперационной эффективности передней доли гипофиза. В настоящее время заболеваемость несахарным диабетом как осложнением операции на аденоме гипофиза составляет 6-11 % [12, 22]. Вполне возможно, что эндоскопическая техника может уменьшить случайную ятрогенную травму за счет лучшей визуализации гипофиза, тем самым сохраняя его функциональность [12, 26]. Сосудистые осложнения очень редки. Наиболее частым осложнением является носовое кровотечение (1-3 % случаев) [20, 22]. Повреждение внутренней сонной артерии является чрезвычайно редким (0-1,3 %), но серьезным осложнением, которое требует немедленного нейрорадиологиче- ского вмешательства с эндоваскулярной окклюзией поврежденного сосуда [22].
Контроль и наблюдение
Регулярный контроль зависит от размера опухоли и динамики ее роста. Однако обычно проводится ежегодная МРТ-проверка и двухлетнее эндокринное и офтальмологическое обследование. Важным аспектом является возраст. Молодым пациентам рекомендуется хирургическое вмешательство, даже если функция гипофиза сохраняется. Первый эндокринологический послеоперационный контроль нужно проходить через 4-6 недель. Дальнейший контроль проводится ежегодно у пациентов без нарушения парциальных функций гипофиза и у пациентов с нарушениями после первоначальной заместительной терапии с интервалом в полгода. Первый послеоперационный контроль с помощью МРТ обычно делают через 3-6 месяцев после операции. Дальнейший контроль проводится раз в год, а затем раз в 2-3 года.
Выводы
- Аденомы гипофиза представляют собой внутричерепные опухоли, которые могут проявляться различными симптомами.
- Важным является своевременное обнаружение и проведение необходимой диагностики.
- Необходимо сотрудничество радиологов, эндокринологов и офтальмологов.
- Если эндокринологические, офтальмологические или неврологические симптомы показывают подтвержденное визуализацией увеличение гипофиза, необходимо начать лечение.
- За исключением пролактиномы, предпочтительным лечением является транссфеноидальная резекция опухоли, которая, в зависимости от размера необходимого доступа, проводится в сотрудничестве с врачами ЛОР.
- Для опухолевых остатков или рецидивов может быть показана лучевая терапия, главным образом в форме стерео- таксического излучения однократного воздействия.
- Последующая терапия должна осуществляться в тесном междисциплинарном сотрудничестве.
- При адекватной терапии могут быть достигнуты очень хорошие онкологические и функциональные результаты.
Информация о конфликте интересов. Конфликт интересов отсутствует.
Инфoрмaция o спoнсoрстве. Дaннaя рaбoтa не финaнсирoвaлaсь.
Список литературы
1. Lloyd R.V., Osamura R.Y., Klöppel G., Rosai J. (eds.) WHO classification of tumours of endocrine organs. Lyon: IARC, 2017. 355 p.
2. McDowell B.D., Wallace R.B., Carnahan R.M., Chrischilles E.A., Lynch C.F., Schlechte J.A. Demographic differences in incidence for pituitary adenoma. Pituitary. 2011,14(1):23–30. DOI: 10.1007/s11102-010-0253-4
3. Tjörnstrand A., Gunnarsson K., Evert M., Holmberg E., Ragnarsson O., Rosén T., et al. The incidence rate of pituitary adenomas in western Sweden for the period 2001–2011. Eur J Endocrinol. 2014,171(4):519–26. DOI: 10.1530/EJE-14-0144
4. Askitis D., Tsitlakidis D., Müller N., Waschke A., Wolf G., Müller U.A., et al. Complete evaluation of pituitary tumours in a single tertiary care institution. Endocrine. 2018,60(2):255–62. DOI: 10.1007/s12020-018-1570-z
5. Przybylowski C.J., Dallapiazza R.F., Williams B.J., Pomeraniec I.J., Xu Z., Payne S.C., et al. Primary versus revision transsphenoidal resection for nonfunctioning pituitary macroadenomas: matched cohort study. J Neurosurg. 2016,76(5):889–96. DOI: 10.3171/2016.3.JNS152735
6. Vaz-Guimaraes F., Koutourousiou M., de Almeida J.R., Tyler-Kabara E.C., Fernandez-Miranda J.C., Wang E.W., et al. Endoscopic endonasal surgery for epidermoid and dermoid cysts: a 10-year experience. J Neurosurg. 2018,100(5):1–11. DOI: 10.3171/2017.7.JNS162783
7. Dhandapani S., Singh H., Negm H.M., Cohen S., Souweidane M.M., Greenfield J.P., et al. Endonasal endoscopic reoperation for residual or recurrent craniopharyngiomas. J Neurosurg. 2016,3(5):418–30. DOI: 10.3171/2016.1.JNS152238
8. Ji M.J., Kim J.H., Lee J.H., Lee J.H., Kim Y.H., Paek S.H., et al. Best candidates for dopamine agonist withdrawal in patients with prolactinomas. Pituitary. 2017,20(5):578–84. DOI: 10.1007/s11102-017-0820-z
9. Langlois F., McCartney S., Fleseriu M. Recent progress in the medical therapy of pituitary tumors. Endocrinol Metab. 2017,32(2):162–70. DOI: 10.3803/EnM.2017.32.2.162
10. Schloffer H. Erfolgreiche Operation eines Hypophysentumors auf nasalem Wege. Wien Klin Wochenschr. 1907,20:621–4.
11. Gondim J.A., Almeida J.P., de Albuquerque L.A., Gomes E., Schops M., Mota J.I. Endoscopic endonasal transsphenoidal surgery in elderly patients with pituitary adenomas. J Neurosurg. 2015,123(1):31–8. DOI: 10.3171/2014.10.JNS14372
12. Pala A., Knoll A., Brand C., Etzrodt-Walter G., Coburger J., Wirtz C.R., et al. The value of Intraoperative magnetic resonance imaging in endoscopic and microsurgical transsphenoidal pituitary adenoma resection. World Neurosurg. 2017,102:144–50. DOI: 10.1016/j.wneu.2017.02.132
13. Coburger J., König R., Seitz K., Bäzner U., Wirtz C.R., Hlavac M. Determining the utility of intraoperative magnetic resonance imaging for transsphenoidal surgery: a retrospective study. J Neurosurg. 2014,120(2):346–56. DOI: 10.3171/2013.9.JNS122207
14. Sylvester P.T., Evans J.A., Zipfel G.J., Chole R.A., Uppaluri R., Haughey B.H., et al. Combined high-field intraoperative magnetic resonance imaging and endoscopy increase extent of resection and progressionfree survival for pituitary adenomas. Pituitary. 2015,18(1):72–85. DOI: 10.1007/s11102-014-0560-2
15. Amano K., Aihara Y., Tsuzuki S., Okada Y., Kawamata T. Application of indocyanine green fluorescence endoscopic system in transsphenoidal surgery for pituitary tumors. Acta Neurochir (Wien). 2019,161(4):695–706. DOI: 10.1007/s00701-018-03778-0
16. Li Z., Ji T., Huang G.D., Guo J., Yang J.H., Li W.P. A stratified algorithm for skull base reconstruction with endoscopic endonasal approach. J Craniofac Surg. 2018,29(1):193–8. DOI: 10.1097/SCS.0000000000004184
17. Sanmillán J.L., Torres-Diaz A., Sanchez-Fernández J.J., Lau R., Ciller C., Puyalto P., et al. Radiologic predictors for extent of resection in pituitary adenoma surgery. A single-center study. World Neurosurg. 2017,108:436–46. DOI: 10.1016/j.wneu.2017.09.017
18. Losa M., Spatola G., Albano L., Gandolfi A., Del Vecchio A., Bolognesi A., et al. Frequency, pattern, and outcome of recurrences after gamma knife radiosurgery for pituitary adenomas. Endocrine. 2017,56(3):595–602. DOI: 10.1007/s12020-016-1081-8
19. Graffeo C.S., Link M.J., Brown P.D., Young W.F., Pollock B.E. Hypopituitarism after single-fraction pituitary adenoma radiosurgery: dosimetric analysis based on patients treated using contemporary techniques. Int J Radiat Oncol Biol Phys. 2018,101(3):618–23. DOI: 10.1016/j.ijrobp.2018.02.169
20. Gao Y., Zheng H., Xu S., Zheng Y., Wang Y., Jiang J., et al. Endoscopic versus microscopic approach in pituitary surgery. J Craniofac Surg. 2016,27(2):e157–9. DOI: 10.1097/SCS.0000000000002401
21. Zhan R., Ma Z., Wang D., Li X. Pure endoscopic endonasal transsphenoidal approach for nonfunctioning pituitary adenomas in the elderly: surgical outcomes and complications in 158 patients. World Neurosurg. 2015,84(6):1572–8. DOI: 10.1016/j.wneu.2015.08.035
22. Magro E., Graillon T., Lassave J., Castinetti F., Boissonneau S., Tabouret E., et al. Complications related to the endoscopic endonasal transsphenoidal approach for Nonfunctioning pituitary macroadenomas in 300 consecutive patients. World Neurosurg. 2016,89(C):442–453. DOI: 10.1016/j.wneu.2016.02.059
23. Fan Y., Lv M., Feng Sh., Fan X., Hong H., Wen W., et al. Full endoscopic transsphenoidal surgery for pituitary adenoma-emphasized on surgical skill of otolaryngologist. Indian J Otolaryngol Head Neck Surg. 2014,66(Suppl 1):S334–40. DOI: 10.1007/s12070-011-0317-4
24. Zhang H., Wang F., Zhou T., Wang P., Chen X., Zhang J., et al. Analysis of 137 patients who underwent endoscopic transsphenoidal pituitary adenoma resection under high-field Intraoperative magnetic resonance imaging navigation. World Neurosurg. 2017,104:802–15. DOI: 10.1016/j.wneu.2017.04.056
25. Mortini P., Losa M., Barzaghi R., Boari N., Giovanelli M. Results of transsphenoidal surgery in a large series of patients with pituitary adenoma. Neurosurgery. 2005,56(6):1222–33. DOI: 10.1227/01.NEU.0000159647.6275.9D
26. Laws E.R., Iuliano S.L., Cote D.J., Woodmansee W., Hsu L., Cho C.H. A benchmark for preservation of normal pituitary function after endoscopic transsphenoidal surgery for pituitary macroadenomas. World Neurosurg 2016,91:371–5. DOI: 10.1016/j.wneu.2016.04.059
27. Serra C., Burkhardt J.K., Esposito G., Bozinov O., Pangalu A., Valavanis A., et al. Pituitary surgery and volumetric assessment of extent of resection: a paradigm shift in the use of intraoperative magnetic resonance imaging. Neurosurg Focus. 2016,40(3):E17. DOI: 10.3171/2015.12.FOCUS15564
Об авторах
Башкирский государственный медицинский университет 450008, Уфа, ул. Ленина, 3
Россия
Бейлерли Озал Арзуман оглы — аспирант кафедры урологии с курсом ИДПО
Харбинский медицинский университет Китай, 150081, Хэйлунцзян, Харбин, Наньган, Баоцзянь-роуд, 157
Китай
Shiguang Zhao — профессор, зав. кафедрой нейрохирургии
Башкирский государственный медицинский университет 450008, Уфа, ул. Ленина, 3
Россия
Гареев Ильгиз Фанилевич — аспирант кафедры нейрохирургии и медицинской реабилитации с курсом ИДПО
Харбинский медицинский университет Китай, 150081, Хэйлунцзян, Харбин, Наньган, Баоцзянь-роуд, 157
Китай
Xin Chen — ассистент кафедры нейрохирургии, врач-фармаколог