Журнал «Медицина світу» - Журнал для широкого кола лікарів
ДИАГНОСТИКА И ЛЕЧЕНИЕ
ЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИИ
Желудочковая экстрасистолия (ЖЭ) — наиболее распространенное нарушение сердечного ритма, которое может оказывать существенное влияние на качество жизни больных, выступать признаком структурно-функциональных изменений миокарда и свидетельствовать о риске угрожающих жизни сердечных аритмий. Усовершенствование стратегии ведения больных с ЖЭ в первую очередь связано с развитием концепции “стратификации риска”, то есть разделения пациентов на группы в зависимости от степени риска смерти от всех причин и, в частности, внезапной сердечной смерти (ВСС). Кроме того, активно внедряются современные инструментальные методы диагностики аритмий сердца, в первую очередь — амбулаторное мониторирование ЭКГ. В клинической практике существует очевидная необходимость разработки согласованных рекомендаций по ведению больных с ЖЭ, обобщении диагностических и терапевтических подходов.
ЖЭ может возникать на фоне любой органической патологии сердца. Чаще всего она обнаруживается у больных острым инфарктом миокарда (ИМ) и хронической ИБС. Впрочем, экстрасистолия может возникать также и при других типах поражения миокарда, в том числе субклинических. У многих больных с экстрасистолией с помощью доступных инструментальных методов исследования не удается обнаружить каких-либо признаков поражения сердца.
Распространенные причины и факторы, ассоциированные с ЖЭ:
- Заболевания миокарда, эндокарда и коронарных артерий: ИБС, миокардиты, миокардиофиброз, кардиомиопатии, пороки сердца, артериальная гипертензия или гипотензия, сердечная недостаточность (СН),
- Электролитные нарушения (гипокалиемия, гиперкалиемия, гипомагниемия, гипокальциемия), сдвиги кислотно-щелочного равновесия,
- Гипоксия: заболевания легких, легочная гиповентиляция (например, во время операции),
- Травматические факторы: травмы грудной клетки, операция на сердце, катетеризация полостей сердца, травмы головного и спинного мозга,
- Нарушения вегетативной регуляции: нейроциркуляторная дистония, неврозы, диэнцефалит, симпатические ганглиониты и трунциты, психоэмоциональный стресс,
- Патологические рефлексы, обусловленные заболеваниями органов пищеварения (язвенная болезнь, желчнокаменная болезнь, панкреатит, диафрагмальная грыжа, колиты и энтероколиты, особенно сопровождающиеся метеоризмом, запорами или нарушениями электролитного баланса), дистрофические изменения в шейном и грудном отделах позвоночника (остеохондроз, спондилоартроз), бронхо-легочные нарушения, в частности сопровождающиеся изнурительным кашлем, аденома простаты,
- Диагностические процедуры: эндоскопия (бронхоскопия, гастроскопия, лапароскопия, цистоскопия, кольпоскопия, ректоскопия), пункция, массаж каротидного синуса, надавливание на глазные яблоки, задержка дыхания на глубоком вдохе,
- Аллергия: пищевая, медикаментозная, микробная, профессиональная, бытовая,
- Фармакодинамическое и токсичное действие медикаментов, таких как сердечные гликозиды, хинидин, новокаинамид, средства для наркоза, морфин, глюкокортикоиды, препараты калия, кальция, трициклические антидепрессанты, производные фенотиазина, адреномиметики.
Основные электрофизиологические механизмы экстрасистолии — re-entrу (обратный вход возбуждения) и постдеполяризации. В основе возникновения экстрасистол могут лежать также механизмы асинхронного восстановления возбудимости миокарда и патологического автоматизма.
Обследование больных с ЖЭ включает методы диагностики нарушений сердечного ритма, определение клинического и прогностического значения аритмии, выбор лечения и оценку его эффективности.
Анамнез. При опросе больного выясняется следующая информация: субъективные проявления аритмии (сердцебиение, перебои в работе сердца, толчки или “замирание” сердца, дискомфорт в грудной клетке, ощущение нехватки воздуха, одышка, головокружение, синкопальные состояния), длительность существования нарушений ритма, факторы, провоцирующие аритмию (физическая нагрузка, психоэмоциональный стресс, какое-либо определенное время суток, положение тела, прием пищи, алкоголь, курение), перенесенные в последнее время заболевания, фоновая кардиальная патология, предшествующий прием антиаритмических препаратов (ААП).
Клиническое обследование. Выявление аритмий при аускультации сердца или при пальпации периферических артерий, наличие клинических признаков СН.
Лабораторные методы исследования. Определение содержания калия, натрия, креатинина в сыворотке крови, активности тиреотропного гормона.
ЭКГ. Основные ЭКГ-признаки желудочковых экстрасистол (ЖЭ):
- Преждевременное появление расширенного и деформированного относительно основного ритма комплекса QRS без предшествующего ему зубца Р, за исключением поздних экстрасистол, перед которыми регистрируются зубцы Р, не имеющие электрофизиологической связи с ЖЭ,
- Чаще всего — наличие полной компенсаторной паузы.
Форма ЖЭ зависит не только от локализации источника экстрасистолии, но и от скорости и пути распространения импульса по желудочкам. Поэтому ЭКГ позволяет ориентировочно установить локализацию эктопического очага по морфологии экстрасистолического комплекса. Если ЖЭ имеет вид блокады правой ножки и левой передней ветви пучка Гиса, ее источник находится в системе левой задней ветви пучка Гиса, то есть в задней стенке левого желудочка, если ЖЭ имеет вид блокады правой ножки и задней нижней ветви пучка Гиса, ее источник находится в левой передней ветви пучка Гиса, если ЖЭ имеет вид полной блокады левой ножки пучка Гиса, ее источник находится в правой ножке пучка Гиса. Комплекс QRS левожелудочковой экстрасистолы в правых грудных отведениях имеет моно- или бифазную форму: R, qR, RR’, RS, Rs а в левых — rS или QS. Комплекс QRS правожелудочковой экстрасистолы в правых грудных отведениях имеет форму rS или QS, а в левых — R (табл. 1). Если ЖЭ возникает в области межжелудочковой перегородки, как правило, ее длительность и форма незначительно отличаются от комплекса QRS основного ритма. Форма QRS типа rSR` в отведении V1 характерна для экстрасистол из левой половины межжелудочковой перегородки, а тип R или qR в отведении V6 — для экстрасистол из правой половины перегородки. Направление комплекса QRS экстрасистолического комплекса во всех грудных отведениях вверх свидетельствует о локализации источника ЖЭ в базальных отделах сердца, а направление комплекса QRS вниз — в области верхушки. В сложных для топической диагностики случаях точный источник экстрасистолы не указывается, а только дается заключение о факте наличия ЖЭ.
Таблица 1. Характерные формы комплексов ЖЭ в грудных отведениях ЭКГ при базальной, промежуточной и верхушечной их локализации
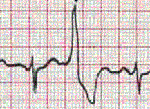
Интервалы сцепления монотопных ЖЭ одинаковые, несмотря на то что их форма может быть различной (в данном случае они являются полиморфными). Колебания интервалов сцепления монотопных экстрасистол, как правило, не превышают 0,06–0,10 с. Политопные ЖЭ характеризуются различными по продолжительности интервалами сцепления и, как правило, разной формой комплексов QRS. Две экстрасистолы подряд называются парными (рис. 1), а три–пять — групповыми, “залповыми” (рис. 2), или пробежками желудочковой тахикардии — ЖТ. Выделяются также ранние и очень ранние ЖЭ („R на Т”) (рис. 3). Экстрасистолия может быть нерегулярной (монотопная или политопная), а ее появление с определенной закономерностью определяется как аллоритмия (бигеминия, тригеминия, квадригеминия и т. д.). Интерполированные ЖЭ регистрируются между двумя нормальными комплексами QRS, как правило, — на фоне брадикардии.
Рисунок 1. Одиночная и парная политопная желудочковая экстрасистолия.
Рисунок 2. Групповая политопная желудочковая экстрасистолия.
Рисунок 3. Ранняя желудочковая экстрасистолия „R на Т”.
Желудочковую экстрасистолию на фоне фибрилляции предсердий следует дифференцировать с аберрантными желудочковыми комплексами. Укороченный кардиоцикл при фибрилляции предсердий, заканчивающийся аберрантным желудочковым комплексом, в отличие от предэкстрасистолического интервала, не сопровождается компенсаторной паузой, а ему предшествует удлиненный интервал RR. Аберрантные комплексы QRS, как правило, имеют форму блокады правой ножки пучка Гиса различной степени тяжести в отведении V1 (rSR’, rSr’), а левожелудочковые экстрасистолы — форму R, RS, Rs, qR, RR’ или Rr’ (табл. 2).
Таблица 2. Дифференциальная диагностика между суправентрикулярными экстрасистолами с аберрацией внутрижелудочковой проводимости
и желудочковыми экстрасистолами
Морфология QRS в отведении V1:
qR, R, rR’ с расщеплением на восходящем колене
qR, R, RS, Rsr’, RR’ с расщеплением на нисходящем колене
Морфология QRS в отведении V6:
Преобладание положительных или отрицательных зубцов комплекса QRS во всех грудных отведениях
ДРУГИЕ МЕТОДЫ ИНСТРУМЕНТАЛЬНОЙ ДИАГНОСТИКИ
Холтеровское мониторирование (ХМ) ЭКГ позволяет регистрировать ЭКГ без ограничения режима двигательной активности больного на протяжении 24 часов и дольше с последующим автоматизированным анализом записи. Оценивается общее количество экстрасистол за время наблюдения, их распределение на протяжении суток, связь с физической или эмоциональной нагрузкой, ЧСС, приемом пищи, изменением положения тела, переходными эпизодами ишемии миокарда.
ХМ ЭКГ — „эталонный” метод диагностики редких эпизодов экстрасистолии, а также оценки тяжести ЖЭ, выявленных во время регистрации ЭКГ. ХМ ЭКГ позволяет точнее, чем кратковременная регистрация ЭКГ, проводить качественную и количественную оценку нарушений сердечного ритма благодаря возможности оценки значительно большего количества эктопических комплексов. Одиночные ЖЭ являются достаточно частой находкой при ХМ ЭКГ у практически здоровых лиц.
Сравнение циркадных изменений количества экстрасистол и частоты сердечных сокращений (ЧСС) позволяет различить тахи- и брадизависимые формы экстрасистолии. Одним из наиболее распространенных суточных типов распределения экстрасистолии является „вагусный” (вагозависимый, или „ночной”), когда внеочередные комплексы регистрируются в 1,5 раза чаще в пассивный период суток, на фоне замедления синусового ритма. Вагозависимая ЖЭ чаще встречается у молодых людей без признаков патологии сердца, нередко является случайной находкой и не ощущается больными. Такая форма экстрасистолии, как правило, не требует антиаритмической терапии. При „адренергическом” (симпатозависимом, или „дневном” типе) среднее количество экстрасистол за час в 1,5 раза больше в активный период суток, их появление часто связано с ускорением синусового ритма. „Адренергический” тип ЖЭ более характерен для пожилых людей, особенно с ИБС, гипертонической болезнью, пороками сердца, дилятационной и гипертрофической кардиомиопатиями, миокардиофиброзом. В отличие от „вагусного” типа, такая экстрасистолия не является доброкачественной и зачастую требует назначения ААП, в частности, β-блокаторов и амиодарона. Довольно часто связь между количеством экстрасистол, периодом суток и ЧСС отсутствует. Также возможен „гектический” тип распределения экстрасистол со значительными колебаниями их количества во времени. Такая высокая эктопическая активность на протяжении короткого промежутка времени иногда может быть связана с рецидивирующей ишемией миокарда. В целом, использование ХМ ЭКГ существенно облегчает диагностику экстрасистолии и парасистолии, определение их форм и вариантов.
Метод ХМ ЭКГ позволяет оценивать вариабельность сердечного ритма за сутки. В частности, снижение стандартного показателя вариабельности сердечного ритма — стандартного отклонения интервалов RR на протяжении суток (SDNN) — ниже 50 мс свидетельствует о нарушениях вегетативной регуляции сердечного ритма и является одним из предикторов ВСС у больных с постинфарктным кардиосклерозом, систолической дисфункцией левого желудочка (ЛЖ) и сердечной недостаточностью при сохраненном синусовом ритме. Мощнейшим предвестником риска угрожающей аритмии является сочетание низкой вариабельности сердечного ритма со сниженной фракцией выброса (ФВ) ЛЖ и нарушением барорефлекса (исследование ATRAMI, 1998). Следует подчеркнуть, что частая ЖЭ ограничивает оценку временных и спектральных показателей вариабельности сердечного ритма.
При ХМ ЭКГ обращается внимание также на продолжительность и вариабельность интервала сцепления, а также на длину интервала Q-T. Возможна оценка суточных колебаний корригированного интервала QT, ведь даже при его непродолжительном увеличении может удлиняться „восприимчивый” период сердечного цикла и возрастать риск пароксизмов „пируэт-тахикардии”.
Повторное ХМ ЭКГ на фоне лечения позволяет оценить эффективность назначенной терапии. Учитывая выраженные спонтанные колебания частоты возникновения аритмий сердца, были разработаны следующие критерии эффективности антиаритмической терапии у больных с ЖЭ: а) уменьшение общего количества ЖЭ за сутки более чем на 50–75%, б) уменьшение количества парных и ранних ЖЭ на 90% и более, в) полное устранение эпизодов ЖТ, г) при полиморфной ЖЭ — уменьшение числа морфологических типов экстрасистол до 1–2. Оценивая адекватность лечения антиаритмическим препаратом, помимо перечисленных критериев, следует также учитывать особенности его влияния на синусовый ритм, проводимость, частоту ишемических эпизодов.
Интерпретация данных ХМ ЭКГ при оценке эффективности антиаритмической терапии в случае ЖЭ имеет определенные ограничения. При применении ААП 1-го класса по классификации V. Williams эффективность по указанным количественным критериям не позволяет прогнозировать выживаемость больных при длительном лечении. Более того, использование некоторых препаратов (флекаинида, энкаинида) в контролированных исследованиях ассоциировалось со значительным повышением риска ВСС. Поэтому у пациентов с тяжелым структурным поражением миокарда (дисфункция ЛЖ после перенесенного ИМ или при дилятационной кардиомиопатии, с/без СН) терапия начинается с этиопатогенетического направления: устраняется ишемия и гемодинамические нарушения. При наличии дисфункции ЛЖ и частых симптомных ЖЭ к базисной превентивной терапии (ингибиторы ангиотензин-превращающего фермента (АПФ), β-адреноблокаторы, аспирин, статины) добавляются амиодарон или соталол — средства с доказанной эффективностью в профилактике злокачественных желудочковых аритмий. Отметим, что β-адреноблокаторы и амиодарон могут назначаться эмпирически, учитывая доказанную способность данных препаратов улучшать прогноз выживаемости больных, и независимо от изменений количества нарушений сердечного ритма. В таких ситуациях ХМ ЭКГ целесообразно контролировать в динамике для оценки нарушений сердечного ритма на фоне антиаритмической терапии. А в ситуациях, когда назначение ААП определяется прежде всего клинической значимостью нарушений ритма, а не их прогностическим значением, определяющим критерием эффективности препарата является уменьшение симптомов аритмии. Отметим также, что наиболее эффективным методом предотвращения ВСС у пациентов группы высокого риска является имплантация внутреннего кардиовертера-дефибриллятора.
Пробы с физической нагрузкой (проба Мастера, степ-тест, велоэргометрия, тредмил-тест) могут провоцировать появление ЖЭ во время нагрузки и в раннем восстановительном периоде в результате повышения активности симпатоадреналовой системы, повышения выброса катехоламинов, развития тканевой гипоксии, ацидоза. У больных с хронической ИБС во время велоэргометрии ЖЭ обнаруживаются у 60% обследованных, а их частота нередко коррелирует со смещением сегмента ST (рис. 4). Под воздействием физической нагрузки может измениться количество и градация экстрасистол: увеличение количества последних во время нагрузки при высокой ЧСС или в первую минуту после ее окончания свидетельствует о ее возможной связи с ИБС, “доброкачественные” экстрасистолы, как правило, исчезают во время нагрузки и возобновляются через 3–5 минут после ее окончания. Следует учитывать диагностические ограничения пробы с нагрузкой: у некоторых больных не удается спровоцировать экстрасистолию, диагностированную раньше, у 11–40% пациентов со здоровым сердцем при физической нагрузке появляются одиночные экстрасистолы, а у 5% — парные, у некоторых больных при физической нагрузке могут исчезать даже групповые и ранние экстрасистолы.
Рисунок 4. Правожелудочковая экстрасистола на фоне горизонтальной депрессии сегмента ST.
Ортоклиностатическая проба позволяет уточнить характер экстрасистолической аритмии: стабильная экстрасистолия существует в покое и при функциональных пробах, лабильная экстрасистолия напряжения появляется или усиливается при ортостатической пробе и стандартной нагрузке мощностью 50 Вт, лабильная экстрасистолия покоя исчезает при ортостатической пробе и физической нагрузке мощностью 50 Вт и появляется после перехода в горизонтальное положение. Считается, что лабильная экстрасистолия напряжения и стабильная экстрасистолия, скорее всего, связаны с наличием заболевания сердца и/или стойкого субстрата аритмии, а лабильная экстрасистолия покоя, как правило, является функциональной (вагусной).
Эхокардиография выполняется для уточнения влияния как ЖЭ, так и ААП на состояние гемодинамики. Метод позволяет оценить размеры полостей сердца в систолу и диастолу, фракцию выброса, толщину стенок сердца, массу миокарда ЛЖ, соотношение конечно-диастолического объема и массы миокарда ЛЖ, выявить зоны гипо- и акинезии, локальную гипертрофию, клапанные пороки, феномен “постэкстрасистолического усиления”, дисплазию миокарда правого желудочка. Уменьшение ФВ ЛЖ ниже 40% у больных с ИБС ассоциируется с повышением риска ВСС. Сердечный выброс можно точнее определить с помощью радиоизотопной вентрикулографии или коронаровентрикулографии.
Внутрисердечное ЭФИ является современным методом диагностики нарушений ритма и проводимости сердца, определения показаний для кардиостимуляции, радиочастотной катетерной абляции и вживления кардиовертера-дефибриллятора. Исследование выполняется в специально оборудованных лабораториях. У больных с ЖЭ абсолютных показаний для проведения внутрисердечного ЭФИ нет. Данное исследование может быть осуществлено лишь при необходимости установления связи нарушений ритма сердца с синкопальными и пресинкопальными состояниями. Больным с бессимптомным ходом экстрасистолии ЭФИ не показано.
КЛИНИЧЕСКОЕ И ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ
Клиническое значение ЖЭ в основном определяется ее типом и градацией, наличием симптомов, характером основного заболевания, степенью поражения сердца и функциональным состоянием миокарда.
Желудочковые экстрасистолы у лиц без структурного поражения сердца не угрожают жизни. Они обнаруживаются при ХМ ЭКГ у большинства практически здоровых лиц всех возрастных групп, причем у 10% они политопные и редко — групповые. В целом, ЖЭ не обязательно указывают на сопутствующую кардиальную патологию, а при отсутствии сердечного заболевания не являются предвестником возрастания заболеваемости и смертности. С другой стороны, у больных с выраженным структурным поражением сердца и дисфункцией миокарда, особенно на фоне постинфарктного кардиосклероза или СН, выявление частой ЖЭ является дополнительным прогностически неблагоприятным фактором.
Эктопическая активность желудочков отмечается у 75–90% больных острым инфарктом миокарда в первые 72 часа заболевания и обусловливает высокую частоту ВСС в это время, но не коррелирует со смертностью на протяжении года. Наличие ЖЭ в более поздний период заболевания указывает на неблагоприятный долгосрочный прогноз. Так, частота ЖЭ до 1 в час наблюдается у 50% больных при выписке из стационара и указывает на двухлетнюю смертность около 5%. При более частой ЖЭ (1–10 в час), наблюдающейся у 20% больных, смертность достигает 20%. Короткие пароксизмы ЖТ наблюдаются у 12% больных, а смертность от всех причин достигает 30% на протяжении первого года после перенесенного ИМ. Развитие угрожающих аритмий сердца после ИМ обусловлено сочетанием рецидивирующей ишемии с метаболическими и электролитными нарушениями. Важными факторами, способствующими аритмогенезу, являются СН и стенозирующий коронарный атеросклероз.
Парные и политопные ЖЭ встречаются у 70–90% больных с СН, а короткие эпизоды ЖТ — у 40–80%. В подобном случае желудочковые нарушения сердечного ритма являются неблагоприятным прогностическим фактором, причем 33–47% всех случаев смерти больных СН приходится на ВСС. Аритмогенными факторами при СН является дисфункция левого желудочка (ФВ <45%), ишемия миокарда, гипоксия, электролитные нарушения, а также аритмогенные эффекты примененных лекарственных препаратов, особенно сердечных гликозидов, диуретиков и периферических вазодилятаторов.
Очень высокой является частота ЖЭ у больных дилятационной кардиомиопатией. Частые и политопные ЖЭ наблюдаются у 80–90% больных, короткие эпизоды ЖТ — у 20–60%. Частота ВСС достигает 10% в год, на нее приходится половина всех случаев смерти. Приблизительно у 50% больных выявляются предсердные экстрасистолы. Развитие аритмий связано с наличием выраженной дисфункции ЛЖ и СН.
Желудочковые экстрасистолы регистрируются у 50–65% больных гипертрофической кардиомиопатией с обструкцией выносящего тракта ЛЖ, в том числе парные ЖЭ — у 32%, а пароксизмы ЖТ — у 14–25%. Частота ВСС у таких пациентов составляет 2,5–9% в год. Предсердная экстрасистолия встречается реже желудочковых нарушений ритма. Причины и факторы аритмогенеза: клеточная дезорганизация в различных зонах миокарда, гипоксия, гипокалиемия, обструкция выносящего тракта ЛЖ, диастолическая дисфункция ЛЖ, СН, аритмогенные эффекты препаратов, интенсивные физические нагрузки.
Риск ВСС в результате желудочковых нарушений ритма особенно возрастает у больных с аритмогенной дисплазией правого желудочка, врожденным или приобретенным синдромом удлиненного интервала QT, клапанными пороками сердца (включая пролапс митрального клапана), артериальной гипертензией.
О степени опасности, связанной с ЖЭ, могут свидетельствовать некоторые ЭКГ признаки. Не представляют угрозы экстрасистолы с конфигурацией блокады левой ножки пучка Гиса и вертикальным положением электрической оси внеочередного комплекса QRS (тип Розенбаума) или когда комплекс QRS экстрасистолы во всех грудных отведениях направлен вверх и напоминает картину синдрома Вольфа-Паркинсона-Уайта типа А (тип Вольфа). Комплекс QRS таких экстрасистол не имеет дополнительных расщеплений, его амплитуда составляет 20 мм и более, длительность может достигать 0,12 с, а сегмент ST и асимметричный зубец Т направлены дискордантно к основному зубцу желудочкового комплекса. Перегородочные ЖЭ с узкими комплексами QRS чаще наблюдаются у молодых людей при отсутствии структурного поражения сердца и редко являются симптомными. ЖЭ, представляющие потенциальную угрозу, чаще возникают на фоне органического поражения сердца, имеют форму блокады правой ножки пучка Гиса, низкую амплитуду комплекса QRS (часто до 10 мм) с дополнительными расщеплениями при продолжительности последнего более 0,12–0,14 с. Могут наблюдаться нарушения реполяризации: горизонтальная депрессия сегмента ST и конкордантное направление симметричного, заостренного зубца Т.
КЛАССИФИКАЦИИ ЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИИ
Согласно рекомендациям Ассоциации кардиологов Украины, созданным на основе Международной классификации болезней Х пересмотра, выделяются следующие виды экстрасистолии: предсердная, атриовентрикулярная, желудочковая (одиночная — до 30 в час, частая — 30 и более в час, аллоритмия, полиморфная, парная, ранняя — типа „R на Т”).
В Украине при интерпретации данных ХМ ЭКГ у больных с желудочковыми нарушениями ритма традиционно используется классификация B. Lown и M. Wolf (1971). Согласно данной классификации выделяется 5 классов желудочковых экстрасистол: 1) мономорфная < 30 в час, 2) мономорфная >30 в час, 3) полиморфная, 4) парная (4а) и пробежки желудочковой тахикардии (4b), 5) ранняя („R на T”). Указанная классификация была разработана для систематизации желудочковых нарушений сердечного ритма у больных острым ИМ, но не соответствует критериям стратификации риска и подбора тактики дифференцированного лечения у постинфарктных пациентов. Подробнее варианты желудочковых нарушений сердечного ритма отражены в классификации R. Myerburg (1984), которую удобно использовать при интерпретации результатов ХМ ЭКГ (табл. 3). Отметим, что при стратификации риска у постинфарктных больных значимым является уже количество ЖЭ более 10 в час. К аритмиям „высоких градаций” относятся парные ЖЭ и пароксизмы ЖТ любой продолжительности. Причем стойкая ЖТ, независимо от клинических симптомов и характера органической патологии сердца, рассматривается как злокачественное нарушение ритма, тогда как прогностическое значение неустойчивой ЖТ четко зависит от основного заболевания сердца и функционального состояния миокарда. Морфологический тип ЖТ также предопределяет существенную разность в механизмах возникновения и тактике ведения больных, в частности, применение ААП и катетерных методов лечения.
Таблица 3.
Систематизация желудочковых нарушений сердечного ритма по R. Myerburg (1984)
•Из выносящего тракта правого желудочка
Нечасто (2–9 в час)
Промежуточная (10–29 в час)
Парные, пробежки (2 или 3–5 комплексов)
Неустойчивая желудочковая тахикардия (от 6 комплексов до 29 с)
Стойкая желудочковая тахикардия (≥ 30 с)
Хорошо известна прогностическая классификация желудочковых аритмий, предложенная J. T. Bigger (1993), разделяющая желудочковые аритмии на безопасные (доброкачественные), угрожающие жизни (злокачественные, летальные) и потенциально опасные (потенциально летальные).
- Безопасные (доброкачественные) аритмии — любые ЖЭ (редкие, частые, политопные, парные), а также короткие эпизоды ЖТ при отсутствии кардиальной патологии, не вызывающие нарушений гемодинамики. Прогноз при таких ЖА такой же, как у здоровых субъектов. Показаний к антиаритмической терапии нет.
- Угрожающие жизни (злокачественные) желудочковые аритмии — эпизоды ЖТ, приводящие к нарушению гемодинамики или фибрилляции желудочков (ФЖ). Подобные аритмии, как правило, наблюдаются у больных с тяжелой органической патологией сердца (ИБС, застойная СН, кардиомиопатии, пороки сердца) и нарушением сократимости ЛЖ. У этих больных ЖЭ является лишь частью спектра желудочковых нарушений ритма. Достаточно часто у них также обнаруживаются неустойчивые и стойкие ЖТ.
- Потенциально опасные (потенциально злокачественные) желудочковые аритмии — частые, политопные, парные ЖЭ, короткие эпизоды ЖТ у больных со структурной патологией сердца (ИБС, СН, кардиомиопатии, пороки сердца), не приводящие во время нарушений ритма к выраженным изменениям гемодинамики. Маркером высокого риска угрожающих жизни аритмий сердца у таких больных является систолическая дисфункция ЛЖ (ФВ ЛЖ < 45%).
ПРИНЦИПЫ ЛЕЧЕНИЯ БОЛЬНЫХ
Тактика ведения больных с ЖЭ зависит от: а) структурного заболевания сердца, б) частоты возникновения экстрасистол, наличия групповых экстрасистол или сопутствующих пароксизмов тахиаритмии, в) клинических симптомов, связанных с аритмией. Показания для назначения β-блокаторов и/или других ААП следующие: 1) прогрессирование заболевания сердца с существенным увеличением количества ЖЭ, 2) частые, политопные, парные, групповые и ранние („R на T”) ЖЭ, свзанные с риском последующего возникновения пароксизмальной ЖТ и ФЖ, 3) аллоритмия (би-, три-, квадригеминия), короткие пробежки ЖТ, сопровождающиеся признаками СН, 4) ЖЭ на фоне заболеваний, сопровождающихся повышением риска угрожающих жизни аритмий (пролапс митрального клапана, синдром удлиненного интервала Q-T и т. п.), 5) возникновение или увеличение частоты ЖЭ во время приступов стенокардии или острого ИМ, 6) сохранение ЖЭ после приступа ЖТ и ФЖ, 7) экстрасистолы на фоне аномальных путей проведения (синдромы Вольфа-Паркинсона-Уайта и Клерка-Леви-Кристеско).
Больные с доброкачественной ЖЭ в специальной антиаритмической терапии не нуждаются, тем не менее, необходимо динамическое наблюдение, потому что у некоторых из них, по данным Фремингемского исследования, ЖЭ может быть дебютом сердечного заболевания. При экстрасистолии у лиц молодого возраста без структурного поражения сердца, особенно исчезающей во время физической нагрузки, ААП, как правило, не назначаются. При субъективной непереносимости экстрасистолии показаны рациональная психотерапия, седативные средства, транквилизаторы или антидепрессанты. Срок лечения зависит от медицинских показаний и колеблется от трех недель до 2–3 месяцев. В случае достижения стойкого седативного и антиаритмического эффекта суточная доза препарата на протяжении каждых 6–7 дней снижается на одну треть до полной отмены. Если экстрасистолия возникает на фоне вегетативной дисфункции с признаками симпатоадреналовой активации, показаны β-адреноблокаторы, а в случае преобладания ваго-инсулярных симптомов — М-холинолитики (атропин, препараты белладонны, итроп). Больные с заболеваниями внутренних органов и экстрасистолией в первую очередь нуждаются в адекватном лечении основного заболевания. Во всех случаях обследование направлено на выявление и устранение потенциальных провоцирующих факторов экстрасистолии (таких как употребление кофеина, определенные жизненные ситуации), а также сопутствующих нарушений (артериальная гипертензия).
При одиночных монофокусных ЖЭ у больных с сердечно-сосудистыми заболеваниями без нарушений гемодинамики и коронарного кровообращения назначать ААП не нужно. Сдержанный подход к назначению ААП обусловлен тем, что риск побочных эффектов при медикаментозном лечении “доброкачественных” аритмий преобладает над пользой от лечения. Введение таких больных заключается прежде всего в лечении основного заболевания, а также использовании седативных средств и методов психотерапии при субъективной непереносимости аритмии.
Потенциально злокачественные желудочковые аритмии, как правило, возникают на фоне структурного заболевания сердца, например, ИБС или после перенесенного ИМ. У таких больных с ЖЭ разных градаций имеет место риск пароксизмов ЖТ, трепетания или фибрилляции желудочков. Ввиду этого больные с потенциально злокачественными желудочковыми аритмиями прежде всего нуждаются в адекватном лечении основного заболевания. С этой целью осуществляется коррекция стандартных факторов риска ИБС (артериальная гипертензия, курение, гиперхолестеринемия, сахарный диабет), назначаются средства, эффективность которых доказана у больных с ИБС (аспирин, β-адреноблокаторы, статины) и при СН (ингибиторы АПФ, β-адреноблокаторы, антагонисты альдостерона). При сочетании кардиальной патологии с частой ЖЭ высоких градаций осуществляется подбор адекватной антиаритмической терапии. Препаратами выбора чаще всего является β-адреноблокаторы, особенно при наличии дополнительных показаний: ИБС, артериальной гипертензии, синусовой тахикардии. Высокая эффективность данных препаратов связана с их антиангинальным, антиаритмическим и брадикардитическим эффектом. При необходимости β-адреноблокаторы комбинируются с ААП I класса (пропафенон, этмозин, этацизин, дизопирамид) с учетом целесообразности их последующего длительного приема.
Гипотеза о профилактической эффективности ААП I класса при ЖЭ для предотвращения внезапной смерти была пересмотрена после публикации результатов исследования CAST (1989). Прием флекаинида и энкаинида у постинфарктных больных с бессимптомными ЖЭ высоких градаций сопровождался достоверным возрастанием риска внезапной смерти по сравнению с плацебо. Указанный феномен связан с аритмогенным и отрицательным инотропным действием ААП I класса. В то же время отрицательные результаты исследования CAST и других исследований эффективности ААП I класса не исключают возможности их эффективного краткосрочного использования с целью лечения ЖЭ у больных с ИБС, а также при других причинах желудочковых аритмий.
При недостаточной эффективности β-адреноблокаторов и ААП I класса назначается амиодарон — мощнейший из существующих антиаритмических средств с минимальным риском аритмогенных эффектов. Амиодарон применяется в случае резистентности к другим ААП, кроме того, он является препаратом выбора у больных с угрожающими и клинически значимыми аритмиями на фоне тяжелой органической патологии сердца. Обнадеживающие результаты получены при использовании амиодарона у больных с частой ЖЭ после перенесенного ИМ в мета-анализе АТМА (1997). В группах больных, получавших амиодарон, риск ВСС существенно снижался, однако достоверного снижения показателей общей смертности не наблюдалось. Амиодарон — препарат выбора для лечения и профилактики желудочковых аритмий у больных с систолической дисфункцией миокарда и СН. Использование амиодарона в низких дозах (200 мг в сутки) позволяет свести к минимуму количество некардиальных побочных эффектов. Альтернативным средством лечения больных с желудочковыми аритмиями на фоне ИБС является соталол — ААП ІІІ класса с β-блокирующими свойствами.
Высокая эффективность амиодарона и соталола при лечении больных со злокачественными желудочковыми аритмиями не свидетельствует об отсутствии проблемы безопасности данных средств. ААП ІІІ класса удлиняют корригированный интервал Q-T, безопасные пределы которого составляют 440–460 мс. Если показатели интервала Q-Tс превышают указанные границы, диагностируется приобретенный синдром удлиненного интервала Q-T. Характерным и специфическим проявлением данного состояния является полиморфная ЖТ (пируэт-тахикардия), которая может трансформироваться в ФЖ. Риск развития аритмогенного действия соталола максимален в первые три дня приема препарата. В целом, аритмогенные эффекты соталола наблюдаются чаще, нежели на фоне амиодарона.
Желудочковая экстрасистолия — наиболее распространенное в клинической практике нарушение ритма сердца. Она может возникать при многих кардиальных и экстракардиальных заболеваниях, являться случайной находкой у практически здоровых лиц. Комплекс современных инструментальных и лабораторных методов обследования пациентов с ЖЭ направлен на установление ее причин и механизмов, количества и градации экстрасистол, клинического и прогностического значения, осуществления стратификации риска. Общая стратегия ведения больных с ЖЭ и, в частности, целесообразность ее купирования с помощью ААП определяются в зависимости от соотношения потенциальной пользы лечения аритмий, улучшения прогноза выживаемости и риска развития аритмогенных и других побочных эффектов терапии.
- Амбулаторне моніторування ЕКГ. Сучасні технології, діагностичні можливості, показання: Метод. посібник / Бобров В. О., Жарінов О. Й., Куць В. О. та співавт. — Львів: Медицина світу, 2004. — 68 с.
- Бобров В. О., Жарінов О. Й. Шлуночкові аритмії (механізми розвитку, вплив дисфункції міокарда, прогностична оцінка, диференційоване лікування). — Львів, 1995. — 122 с.
- Дабровски А., Дабровски Б., Пиотрович Р. Суточное мониторирование ЭКГ.— М.: Медпрактика, 2000. — 208 с.
- Дослідження варіабельності серцевого ритму в кардіологічній практиці: Метод. реком. / Бобров В. О., Чубучний В. М., Жарінов О. Й. та співавт. — К: Укрмедпатентінформ, 1999. — 25 с.
- Кушаковский М. С. Аритмии сердца. — СПб.: ИКФ “Фолиант”, 1998. — 640 с.
- Орлов В. Н. Руководство по электрокардиографии. — М.: Медицинское информационное агентство, 2003. — 526 с.
- Стратифікація ризику і профілактика раптової серцевої смерті: Метод. реком. / Бобров В. О., Жарінов О. Й., Сичов О. С. та співавт. — К: Укрмедпатентінформ, 2002 . — 39 с.
- Функциональная диагностика в кардиологии / Под ред. Л. А. Бокерия, Е. З. Голуховой, А. В. Иваницкого. — М.: Изд-во НЦССХ им. А. Н. Бакулева РАМН, 2002. — Т. 1 — 427 с., т. 2 — 296 с.