Кавернозные ангиомы» ствола головного мозга. Клинические проявления, диагностика и результаты лечения

Кавернома симптомы и лечение
Список сокращений
ИНМ — интраоперационный нейромониторинг
КА — кавернозная ангиома
КТ — компьютерная томография
МикроАВМ — артериовенозная микромальформация
МРТ — магнито-резонансная томография
ШК — шкала Карновского
Каверномы ствола головного мозга из всех кавернозных ангиом (КА) центральной нервной системы выделены в отдельную группу из-за высокой склонности этих мальформаций к повторным кровоизлияниям, а также из-за сложности хирургического вмешательства, сопряженного с высоким риском ухудшения состояния [1—7]. В последние десятилетия благодаря развитию магнитно-резонансной диагностики и совершенствованию микрохирургической техники увеличилась частота выявления больных с этой формой патологии, возрос объем проводимых операций. Однако взгляд на эту патологию, подход к выбору метода лечения, анализ результатов лечения на сегодняшний день принципиально не изменились [1, 4, 7—11]. На это указывает хотя бы тот факт, что до сих пор в литературе используется классификация, предложенная еще в 1994 г. J. Zabramski и соавт. [12, 13]. В данной классификации под названием «КА ствола» объединены как истинные каверномы, так и хронические гематомы и последствия перенесенных ранее кровоизлияний. Несовершенство этой классификации привело к тому, что результаты лечения оцениваются без учета разнородности патологии, это не позволяет сделать правильные выводы и сформулировать точные показания к операции или консервативному ведению пациентов.
В Национальном медицинском исследовательском центре нейрохирургии им. акад. Н.Н. Бурденко (НМИЦ нейрохирургии им. акад. Н.Н. Бурденко) за прошедшие 30 лет накоплен большой опыт хирургического и консервативного лечения пациентов с КА ствола головного мозга. Анализ этого материала позволяет нам изложить свой взгляд на классификацию, особенности естественного течения заболевания и подход к лечению этой патологии.
Цель исследования — на основании собственного опыта определить показания к операции и возможность прогнозирования исходов оперативного лечения пациентов с КА.
Материал и методы
В период с января 1986 г. по декабрь 2017 г. в НМИЦ нейрохирургии им. акад. Н.Н. Бурденко находилось на лечении и амбулаторном обследовании 515 пациентов с КА ствола головного мозга, из них 322 прооперированы, в 193 случаях выбрана тактика консервативного ведения. В основу данной работы положен проспективный и ретроспективный анализ клиники, семиотики магнитно-резонасной (МРТ) и компьютерной томографий (КТ), а также ближайших результатов хирургического лечения у 301 пациента с КА (до декабря 2016 г.). Отдаленные результаты лечения изучены у 187 пациентов, которым проведено обследование и/или оперативное лечение в период с 2000 по 2010 гг. Выборка пациентов обусловлена тем, что, во-первых, срок катамнестического наблюдения составил более 5 лет, во-вторых, возможностью регулярного наблюдения с оценкой неврологического статуса и результатов МРТ. В эту группу не включены пациенты, прооперированные в указанный период времени, но проживающие в отдаленных регионах Российской Федерации или в ближайшем зарубежье, из-за сложности получения точных проспективных данных.
Возраст пациентов варьировал от 1 года до 69 лет (в среднем — 31 год), 19% пациентов были младше 16 лет. Преобладали лица женского пола, причем во всех возрастных группах (р 3 ), несмотря на их персистенцию. На момент осмотра оценка по ШК составила 80 баллов. За время наблюдения медленное улучшение неврологической симптоматики продолжалось еще на протяжении 1,5 лет, но полного регресса неврологического синдромокомплекса не произошло ни у одного пациента. Сохраняющийся резидуальный неврологический дефицит ни в одном случае существенно не препятствовал социальной адаптации (ШК — 90 баллов).
В 13% случаев первичная консультация пациентов проводилась уже в период полной резорбции кровоизлияния (спустя 8—12 мес), когда при МРТ выявлялась лишь зона понижения сигнала в режиме Т2 (гемосидерин). Клинически у этих пациентов наблюдалась практически полная ремиссия (оценка по ШК 90—100 баллов).
За все время катамнестического наблюдения повторные кровоизлияния зарегистрированы у 9% пациентов. У большинства из них (66%) развившаяся незначительная неврологическая симптоматика полностью регрессировала в течение месяца на фоне консервативной терапии. Преимущественно это пациенты с КА. У 28% больных повторное кровоизлияние явилось показанием к хирургическому вмешательству. Это пациенты, которые первоначально проконсультированы на стадии резорбции кровоизлияния. Во время операции у всех больных выявлена КА, подтвержденная при гистологическом исследовании.
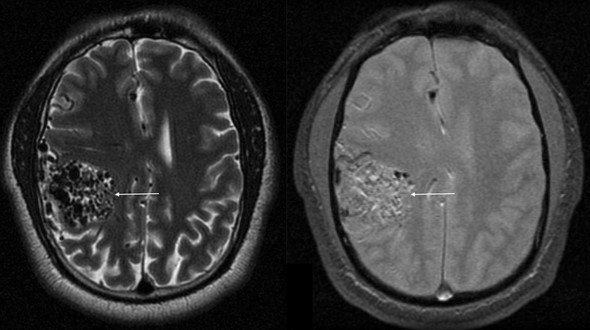
У 6% пациентов с МРТ верифицированными КА применено радиохирургическое лечение, которое принципиально не повлияло на дальнейшее течение заболевания. В среднем через 3 года после радиохирургии у всех пациентов развились повторные кровоизлияния. За период наблюдения, в среднем 6 (от 4 до 10) лет, помимо множественных микрокровоизлияний у этих пациентов неоднократно наблюдалась клиника развернутого кровоизлияния с последующим парциальным регрессом симптоматики (рис. 11 а, б).

Обсуждение
Проблема КА ствола головного мозга сложна и многогранна. В этой работе мы остановимся лишь на основных, с нашей точки зрения, аспектах этой патологии.
Первая проблема — неоднородность самой формы заболевания, которая, в соответствии с принятой на сегодняшний день классификацией, в литературе объединена под одним общим термином «КА ствола головного мозга».
Это, наверное, самое главное, что мы считаем необходимым обсудить.
Анализ более 500 наших наблюдений дает основание выделить две принципиально разные группы:
- Гематомы (подострые, хронические), обусловленные кровоизлиянием из сосудистых микромальформаций, в том числе и из КА, не выявляемых при МРТ.
- Визуализируемые при МРТ типичные КА как в стадии кровоизлияния, так и вне ее.
Принципиальные различия в этих группах проявляются не только в характеристиках МРТ сигнала, но и в течении заболевания, а самое главное — в исходах хирургического лечения.
Для пациентов группы «гематом» характерны более выраженная неврологическая симптоматика на стадии кровоизлияния и более выраженная тяжесть состояния к моменту операции — 50 баллов по ШК для подострых гематом и 60 баллов по ШК для хронических гематом. В то же время тяжесть состояния пациентов в группе КА, даже на стадии кровоизлияния, не снижается ниже 70 баллов, а при КА вне стадии кровоизлияния оно вообще может быть расценено как благополучное (80—90 балов по ШК). Количество предшествующих операции кровоизлияний также различно в этих группах. В случае «гематом» это 1, редко 2 кровоизлияния. В группе КА — 3—4 четко очерченных эпизода кровоизлияния.
Исходы хирургического лечения напрямую зависят от субстрата заболевания. Улучшение состояния непосредственно после операции чаще всего отмечается после удаления гематом. Суммарно во всей группе пациентов с гематомами индекс по ШК после операции возрастает. Напротив, у пациентов с КА после операции отмечается ухудшение со снижением индекса по ШК. Так, непосредственно после операции при подострых гематомах неврологическая симптоматика регрессировала в 77% случаев, при хронических — в 59%, а нарастала в 8 и 18% соответственно. При операциях по поводу КА, проведенных на фоне кровоизлияния, результаты хирургического вмешательства уже не столь благоприятны: усугубление симптоматики после операции отмечается у 33% больных, а регресс симптомов наступает только в 27% случаев. При удалении КА вне стадии кровоизлияния исход в большинстве случаев плохой: симптоматика нарастает у 73% больных, а регрессирует всего у 5%.
Какова же причина кровоизлияний в ствол с формированием гематомы? Это разрыв не выявляемых при МРТ микромальформаций, обнаружить которые во время операции и при гистологическом исследовании биопсийонного материала, по нашим данным, удается лишь в 44% случаев. Из них КА составляют лишь треть. В остальных случаях это либо микроАВМ, либо недифференцируемые патологические сосуды.
Почему кровоизлияния, обусловленные невизуализируемыми при МРТ микромальформациями, протекают тяжелее, чем кровоизлияния из типичных КА? Скорее всего, это связано со скоростью кровотока в самой мальформации. В случае телеангиэктазий и микроАВМ кровоизлияние происходит на фоне большего давления, чем при разрыве КА, кровоток в которых резко снижен.
Почему сосудистая патология при гематомах ствола выявляется лишь в части случаев? Это может быть объяснено рядом причин: малыми размерами мальформации, ее разрушением в момент кровоизлияния, коагуляцией во время операции или аспирацией отсосом при опорожнении гематомы. Патологические сосуды могут сохраниться в капсуле гематомы, если последнюю не удаляли или удалили лишь частично. Не выявленные и не удаленные во время операции патологические сосуды в дальнейшем могут явиться причиной повторных кровоизлияний. В нашей серии наблюдений подобные кровоизлияния в группе гематом возникли в 20% случаев в среднем через 2,5 года после операции.
Таким образом, следует еще раз акцентировать внимание на том, что причиной кровоизлияния в ствол головного мозга могут быть различные типы сосудистых мальформаций, не выявляемых при МРТ, в том числе и микроАВМ, удаление которых может быть сопряжено со значительными трудностями (остановка кровотечения), с чем мы столкнулись в ряде (6%) наших наблюдений.
Вторая проблема, которая не менее важна, чем первая — позволяет ли хирургическое удаление гематомы и/или КА полностью избавить пациента от последующего кровоизлияния?
Как показал наш опыт, операция в большинстве случаев позволяет улучшить состояние пациентов, но, к сожалению, не избавляет их полностью от риска повторного кровоизлияния. Особенно это относится к пациентам с гематомами без КА, подтвержденных при МРТ. В случаях, когда не визуализирована и/или полностью не иссечена мальформация, или же не удалена капсула гематомы, или она удалена частично, риск повторного кровоизлияния в течение года после операции есть у 20% больных. При МРТ-верифицированных КА хирургическое лечение для предотвращения повторного кровоизлияния более эффективно. Даже в случаях частичного удаления мальформации риск повторного кровоизлияния не очень высок и составляет всего лишь 2%.
Анализ причин повторных кровоизлияний позволяет сделать несколько принципиальных выводов относительно хирургической тактики:
— в случае хронических гематом максимальное удаление капсулы снижает риск последующего кровоизлияния,
— при подострых гематомах показана тщательная ревизия их полости для выявления возможной мальформации,
— при КА с кровоизлиянием желательно, по возможности, радикальное удаление мальформации.
В последнее время считается оптимальным проведение контрольного МРТ исследования в течение 72 ч после операции с целью выявления остаточной мальформации. Если последняя обнаруживается, то рекомендуется немедленно проводить повторную операцию для ее удаления, не дожидаясь развития нового кровоизлияния [17].
Парадоксальным представляется отсутствие повторных кровоизлияний у пациентов после частичного удаления КА вне стадии кровоизлияния. Возможно, такой эффект обусловлен склеротическими изменениями в мальформации после операции или изначально ее низкой биологической активностью.
Третья проблема — определение показаний к хирургическому лечению.
Одной из основных задач в лечении патологии, именуемой на сегодняшний день в литературе «КА ствола головного мозга», является предотвращение последующих кровоизлияний, при этом риск развития или нарастания неврологического дефицита должен быть минимальным. В связи с этим выбор тактики ведения (операция или консервативное ведение) всегда сложен [5, 9, 10, 12]. Колебания и сомнения обусловлены, с одной стороны, доказанной вероятностью развития спонтанной ремиссии [18], а с другой, — риском нарастания симптоматики после хирургического вмешательства. Окончательно стратегия ведения каждого конкретного больного на сегодняшний день, по данным литературы, вырабатывается с учетом таких параметров, как время, прошедшее с момента кровоизлияния, количество перенесенных кровоизлияний, тяжесть состояния больного к моменту операции и локализация КА [1, 5, 9, 10, 12, 13, 17, 19, 20].
Наш опыт позволяет считать операцию оправданной у пациентов на стадии кровоизлияния как в группе МРТ выявленных КА, так и при гематомах без установленной при МРТ причины. Важным фактором для окончательного принятия решения является объем кровоизлияния, который определяет тяжесть состояния пациента: чем больше объем гематомы, тем более выражена неврологическая симптоматика и, соответственно, выше обоснованность операции.
Наиболее рискованно удаление КА вне стадии кровоизлияния или на стадии его резорбции, так как более чем у 60% пациентов состояние после операции ухудшается. В этой связи распространенное на сегодняшний день в литературе показание к операции, основанное только на количестве перенесенных ранее кровоизлияний, не совсем правомерно. Если пациент перенес 2—3 кровоизлияния и оптимальный момент для проведения операции (наличие гематомы) уже упущен, то от хирургического лечения лучше воздержаться и продолжить вести пациента консервативно, а к вопросу об операции вернуться только в случае следующего кровоизлияния. Более того, как показали наши наблюдения, количество повторных кровоизлияний ограничено (их число редко превышает 3—4), даже при большой давности болезни.
Еще одним важным моментом при планировании операции у пациентов с КА ствола является локализация мальформации и доступность ее для хирургического удаления. Если мальформация располагается не в глубине ствола мозга, а близко к его поверхности, то ее удаление более обосновано, поскольку риск усугубления неврологической симптоматики меньше.
Очевидно, что эффективность хирургического лечения и, соответственно, выбор тактики ведения определяют не только результаты раннего послеоперационного периода, но и отдаленные исходы операции. В плане прогноза отдаленного исхода хирургического лечения, помимо субстрата заболевания (гематома или КА), имеет значение характер динамики клинических симптомов непосредственно после операции. Кроме больных с ранним послеоперационным регрессом симптоматики, оптимистична перспектива у больных с разнонаправленными послеоперационными изменениями неврологической симптоматики и у пациентов, состояние которых в раннем послеоперационном периоде не изменилось. При нарастании симптомов непосредственно после операции улучшение по сравнению с исходным статусом в отдаленном периоде происходит только у 30% пациентов.
При выборе тактики лечения очень важным представляется точное определение риска развития следующего кровоизлияния. На сегодняшний день объективных критериев для этого нет. Поэтому вопрос оценки «агрессивности» кавернозных мальформаций предельно актуален. Именно маркеры «агрессивности», указывающие на склонность мальформации к последующим кровоизлияниям, могут стать одним из ведущих параметров при выборе показаний к операции. Используемые в мировой литературе критерии, такие как частота кровоизлияния на 1 пациента в год и частота повторных кровоизлияний на 1 пациента в год (до или после лечения), достаточно условны и ненадежны [17, 20—22].
Мы также хотим обратить внимание на тот факт, что, по нашему мнению, патология, объединенная на сегодняшний день в литературе под термином «кавернозная ангиома», не является строго локальной. Помимо самой мальфорации, явившейся причиной кровоизлияния, во время операции практически всегда визуализируются множественные мелкие патологические сосуды (телеангиэктазии), расположенные как субэпендимарно, так и в окружающей каверному и/или гематому глиальной ткани (рис. 12). По нашему мнению, именно эти сосуды в большинстве случаев являются причиной повторных кровоизлияний и источником развития новых микромальформаций (КА).

Выводы
- «Кавернозные ангиомы ствола мозга» — разнородная патология, объединяющая как «классические» каверномы, так и гематомы, обусловленные разрывом не только каверном, но и других «скрытых», не выявленных при магнитно-резонансном томографическом исследовании сосудистых мальформаций (телеангиэктазий, недифференцированного порока развития сосудов, артериовенозных микромальформаций).
- Естественное течение болезни, ее клинические и рентгенологические проявления, а также результаты лечения пациентов этих групп различны.
- Операция показана при гематомах без выявленной при магнитно-резонансном томографическом исследовании причины кровоизлияния. Главной задачей является тщательная ревизия стенок гематомы для выявления мальформации и удаление ее капсулы при хронических кровоизлияниях, при кавернозных ангиомах в стадии кровоизлияния и персистенции неврологической симптоматики. В случае кавернозных ангиом вне стадии кровоизлияния операция может быть показана при неуклонном нарастании симптоматики поражения ствола мозга и при условии доступности мальформации.
- Консервативное ведение оправдано при каверномах вне стадии кровоизлияния и целесообразно у пациентов с кавернозными ангиомами в стадии кровоизлияния в случае регресса или изначально минимально выраженной неврологической симптоматики, даже при наличии предшествующих кровоизлияний в анамнезе.
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Статья основана на многолетнем опыте хирургического лечения каверном ствола головного мозга, накопленном в НМИЦ нейрохирургии им. акад. Н.Н. Бурденко. Проведен анализ особенностей МРТ картины этих образований и операционных находок, которые сопоставлены с ближайшими и отдаленными результатами операций у 322 пациентов и исходами консервативного лечения у 193. После обработки полученных данных авторы сформулировали положения, которые поднимают на новый уровень понимание тактики лечения каверном ствола головного мозга, суть которого состоит в обосновании показаний к операции либо консервативному ведению на основании их морфологических признаков данных образований, клинических проявлений и хирургической доступности.
Новизна исследования состоит в построении хирургической тактики на основе выделения авторами среди гетерогенных форм каверном ствола головного мозга двух групп: гематомы без видимых при МРТ мальформаций и верифицированной МРТ кавернозной ангиомы с кровоизлияниями или без. Принадлежность к одной из этих групп формирует первый шаг в принятии решения в пользу операции, имеющей лучшие исходы при объемных «гематомах», и более взвешенному подходу при МРТ-ви-димых кавернозных ангиомах, результаты хирургического лечения которых не столь благоприятны. Следующий шаг в принятии решения основан на клинико-томографических сопоставлениях, которые позволили авторам выделить варианты клинического течения каверном ствола головного мозга — инсультоподобное и псевдотуморозное, влияющие на скорость принятия решения наряду с морфологическими признаками каверном. В публикации детально очерчена и третья составляющая принятия решения — хирургическая доступность каверномы, которую определяет ее близость к поверхности стволовых образований.
Выстроенная иерархия характеристик каверном ствола головного мозга дает хирургу «жесткие» точки опоры для принятия выверенного решения в пользу операции или консервативного лечения. Представляют ценность для оперирующего хирурга рекомендации по выбору оптимального доступа к каверноме, нюансы препаровки и четкие рекомендации по фрагментарному ее удалению, так как попытки сделать это одним блоком приводят к большей вероятности развития неврологических осложнений после операций. Практически важны и рекомендации, касающиеся послеоперационного контроля и удаления оставшейся части каверномы при ее обнаружении в течение 72 часов после операции.
Не менее практически значимы и сформулированные авторами критерии консервативного ведения каверном ствола головного мозга у 193 пациентов, применение которых позволило избежать неоправданного риска операций и инвалидизации. Авторы раскрывают и проблемные стороны каверном ствола головного мозга — повторные послеоперационные кровоизлияния, рецидивы кавернозных ангиом, в том числе «на пустом месте» после удаления гематом ствола, и ряд других.
Дизайн исследования построен на сравнительном анализе результатов хирургического лечения каверном ствола головного мозга (n=322) в зависимости от принадлежности к группе «гематом» (n=191) или «МРТ-видимых кавернозных ангиом» (n=131). Анализ охватывает весь «период жизни» каверномы, начиная с первых клинических проявлений и диагностики до выбора метода лечения (хирургического или консервативного) и его ближайших и отдаленных результатов в зависимости от принадлежности кавернозной ангиомы к выделенным группам.
Последовательно раскрывая эти аспекты на достаточно большом клиническом материале и тщательном анализе ближайших и отдаленных результатов лечения, авторы обоснованно формулируют основной вывод статьи о лучших результатах хирургического лечения гематом ствола головного мозга и негативных — при кавернозных ангиомах без кровоизлияний. Достаточный клинический материал позволил авторам впервые установить роль числа повторных кровоизлияний из каверномы в принятии решения «за» или «против» операции, выявить факт их лимита, по исчерпании которого операция уже не требуется.
Статья оставляет яркое впечатление и, несомненно, вызовет большой интерес у отечественных и зарубежных нейрохирургов, сталкивающихся с этой проблемой. Основные положения статьи можно охарактеризовать как прорывные, позволяющие «перезагрузить» подходы к тактике при каверномах ствола головного мозга, понять причины ранее допущенных ошибок при лечении, которых теперь удастся избежать.
"