Боль и диспепсия после холецистэктомии - Журнал Доктор Ру
Боль и диспепсия после холецистэктомии
Для цитирования: Кучерявый Ю. А. Боль и диспепсия после холецистэктомии // Доктор.Ру. Гастроэнтерология. 2016. № 1 (118). С. 27–32.
15 января 2016Цель обзора: систематизировать исторические, патофизиологические и клинические факты о постхолецистэктомических расстройствах для формирования базиса тактических врачебных решений в коррекции боли и диспепсии после холецистэктомии.
Основные положения. Холецистэктомия — одно из наиболее частых хирургических вмешательств в мире. Как минимум у половины перенесших ее пациентов сохраняются или возникают жалобы на абдминальную боль и симптомы диспепсии, что принято называть постхолецистэктомическим синдромом. Около половины случаев постхолецистэктомической боли и диспепсии имеют органические причины (стриктура дистального отдела холедоха, холедохолитиаз, острый панкреатит и др.), остальные объясняются функциональными расстройствами (дисфункция сфинктера Одди, функциональная диспепсия, дуоденогастральный рефлюкс, нарушения моторики и функции кишечника), требующими консервативного лечения.
Заключение. Боль и диспепсия после холецистэктомии имеют широкий спектр органических и функциональных причин. Риск их развития повышен у лиц с исходными пограничными расстройствами психики, у пациентов молодого возраста с функционирующим желчным пузырем. Для коррекции большинство врачей предпочитают комбинированную фармакотерапию с обязательным использованием спазмолитических препаратов, в отсутствие эффекта от нее в течение 3 месяцев возможны эндоскопические папиллотомия и стентирование холедоха.
Кучерявый Юрий Александрович — к. м. н., доцент кафедры пропедевтики внутренних болезней и гастроэнтерологии ГБОУ ВПО МГМСУ им. А. И. Евдокимова Минздрава России. 127473, г. Москва, ул. Делегатская, д. 20/1. E-mail: [email protected]
Желчнокаменная болезнь (ЖКБ) в последние несколько десятилетий стала одним из наиболее часто регистрируемых органических заболеваний человека, достигнув распространенности в индустриально развитых странах в пределах 10-15% (в популяции взрослых). Это объясняет большое количество плановых и экстренных хирургических вмешательств по поводу ЖКБ во всем мире [2, 33]. Только в США ежегодно выявляют около 1 млн новых случаев ЖКБ, затраты на лечение этого заболевания превышают 6 млрд долларов в год [16]. В России ежегодно выполняют около 200 тыс. холецистэктомий, в основном лапароскопическим путем [1]. В среднем только у 20% пациентов с ЖКБ отмечается симптомное течение, к которому относится и классическая желчная колика [36]. При таком течении ЖКБ хирургическое вмешательство позволяет достичь купирования симптоматики у 53,0-81,5% пациентов [25, 32, 38], уменьшить выраженность диспепсии и абдоминальной боли в 56% и 72% случаев соответственно [12]. К сожалению, весьма существенная часть пациентов (около 40%) не отмечает разрешения абдоминальной боли и симптомов диспепсии после холецистэктомии, более того, в 12,0-38,6% от всех случаев холецистэктомии мучительные симптомы впервые появляются после оперативного лечения [27, 38]. В целом абдоминальная боль и диспепсия после холецистэктомии регистрируются в широких частотных рамках (от 5,6% до 57,3%), что определяется различиями в дизайне исследований [21, 28, 30, 41, 42]. Таким образом, до половины пациентов в разные сроки от момента холецистэктомии предъявляют жалобы на боли в животе, симптомы желудочной и кишечной диспепсии, которые могут иметь как органические, так и функциональные причины [2, 16].
ПОСТХОЛЕЦИСТЭКТОМИЧЕСКИЙ СИНДРОМ Дефиниция и краткий экскурс в историю Следует отметить, что постхолецистэктомический синдром (ПХЭС) только на первый взгляд является простой проблемой, сложности понимания этого синдрома начинаются уже с его определения [2]. Первые работы, где так или иначе описываются патологические состояния после удаления желчного пузыря, появились в зарубежной литературе в конце 30-х годов прошлого века [19, 23, 31]. Наиболее важной и интересной остается первая серия наблюдений, представленная J. Hellstrom (с учетом данных, полученных K. K. Nygaard) в 1938 г. Она насчитывала 141 пациента после удаления желчного пузыря, 30% от общей выборки имели спастические боли в животе, аналогичные тем, что были до хирургического вмешательства. Только у 9 пациентов удалось выявить холедохолитиаз, еще реже диагностировался острый панкреатит. В большинстве случаев причины болей объяснить не удалось, в связи с чем выявленные боли автор назвал «постхолецистэктомической коликой» [23]. Следующая крупнейшая серия наблюдений была представлена H. Doubilet в устном докладе на заседании хирургической секции Нью-Йоркской академии медицины в апреле 1943 г. [17] и подробно изложена в последующей обзорной работе R. Colp [15]. Цитируемая серия насчитывала 253 пациента после холецистэктомии со сроками наблюдения от 1 года до 7 лет. У 40% пациентов имелись упорные послеоперационные симптомы, зачастую сходные с клиническими проявлениями до холецистэктомии. Именно в этих двух работах [15, 17] впервые встречается термин ПХЭС, в рамках которого авторы объединили комплекс различных расстройств после холецистэктомии. Бóльшая часть постхолецистэктомических расстройств, ввиду отсутствия органических причин (культя пузырного протока, резидуальный холедохолитиаз и т. д.), исследователями тех лет признается функциональными расстройствами, сопровождающимися рецидивными болями по типу колик. Авторы предположили, что базис часто регистрируемых функциональных болей — нарушение моторики спастического типа (дискинезия) сфинктеров билиарного тракта и кишечника, а также пограничные расстройства психики у некоторых больных. Одним из веских оснований для подобного суждения явилась констатация более высокой частоты развития постхолецистэктомических функциональных расстройств у пациентов с потенциально функционирующим желчным пузырем (бескаменный холецистит или калькулезный холецистит без выраженного фиброза стенки желчного пузыря) [15, 17]. Таким образом, авторы впервые в истории изложили четкие представления о возможности формирования постхолецистэктомических расстройств, выделили потенциальные группы признаков, повышающих риск их развития:
- функциональные заболевания, проявлявшиеся жалобами на боль и диспепсию до холецистэктомии, могут персистировать или усугубляться после оперативного вмешательства,
- пограничные расстройства психики у пациентов с функциональными заболеваниями ЖКТ встречаются чрезвычайно широко, тесно переплетаясь в общем патогенезе соматоформного заболевания, поэтому пограничные расстройства психики до хирургического вмешательства по поводу ЖКБ (которая может сочетаться, например, с синдромом раздраженного кишечника — СРК) определенно будут сохраняться и после, формируя стойкую или даже прогрессирующую функциональную симптоматику боли и диспепсии,
- удаление функционирующего желчного пузыря (бескаменный острый холецистит, I стадия ЖКБ с билиарным сладжем, солитарные конкременты у молодых людей) может повышать риск дезадаптивных функциональных расстройств в послеоперационном периоде относительно такового у лиц, прооперированных в иных условиях (нефункционирующий, «отключенный» желчный пузырь и т. п.).
Возвращаясь к первым работам, формировавшим представление о ПХЭС, следует отметить, что гипотеза о спазме сфинктеров билиарного тракта как о причине функциональной боли после холецистэктомии легла в основу эмпирического применения нитратов и атропина для купирования спазма [15]. Ряд простых описательных исследований тех лет позволил разработать показания и даже обсуждать теоретические возможности папиллотомии, опираясь на экспериментальные работы начала прошлого века.
В 1940-1970-е годы термин ПХЭС прочно закрепился и регулярно встречался в научной литературе [14, 34, 37, 39, 40], к середине 1970-х число таких работ достигло ста [2]. Любопытно, что в одной из первых отечественных работ, реферируемых в международных базах данных [10], продемонстрировано скептическое отношение к термину ПХЭС и содержится его активная критика. Что еще более интересно, с конца 60-х годов прошлого века число англоязычных статей на тему ПХЭС в наиболее авторитетных международных журналах стремительно падает и к 80-м годам практически сводится к нулю, в то время как в Восточной Европе и СССР количество работ, посвященных ПХЭС, напротив, значительно увеличивается. В 1980-х годах в связи с отказом от термина ПХЭС в авторитетных англоязычных журналах его успешно стали заменять постхолецистэктомической болью [13, 35], папиллярной дисфункцией [11] и даже, используя терминологию 30-х годов прошлого века, — билиарной дискинезией [26].
Сегодня очевидно, что сложность изучения и верификации постхолецистэктомических расстройств, схожесть симптоматики при органических изменениях и функциональных нарушениях привели к тому, что термин ПХЭС в странах Запада уже к середине 80-х годов XX века перестал использоваться. В международной практике унифицированного термина ПХЭС до сих пор нет, поскольку невероятно сложно определить точный механизм и первопричину боли и диспепсии, возникающих в разные временны́е отрезки после холецистэктомии. Однако, как это ни парадоксально, термин ПХЭС вошел в МКБ-10 и был чрезвычайно популярен в СССР, а сейчас и в России (как в рутинной практике, так и среди научных работников). Широкое признание этого термина в 1970-1980-е годы в СССР не было случайным, оно объяснялось растущим числом холецистэктомий, объективными трудностями диагностики и недостаточным представлением врачей о возможных последствиях вмешательства — от функциональной дезадаптации билиарного тракта (и даже всей системы пищеварения) до грубых органических изменений [2].
В России сегодня под ПХЭС понимается множество различных заболеваний и состояний, которые возникают у больных после холецистэктомии и теоретически могут быть связаны с ней [2]. Именно невозможность объединения органических изменений и функциональных расстройств единым диагнозом привела к отказу от этого термина за рубежом, где любые отклонения у пациента после холецистэктомии, теоретически связанные с ней, рассматриваются как «состояние после холецистэктомии» [24, 29]. По клиническим показаниям в группах риска и при наличии маркеров органических изменений осуществляется диагностический поиск причины, в противном случае устанавливается диагноз дисфункции сфинктера Одди согласно Римским критериям III [18].
Структура постхолецистэктомического синдрома
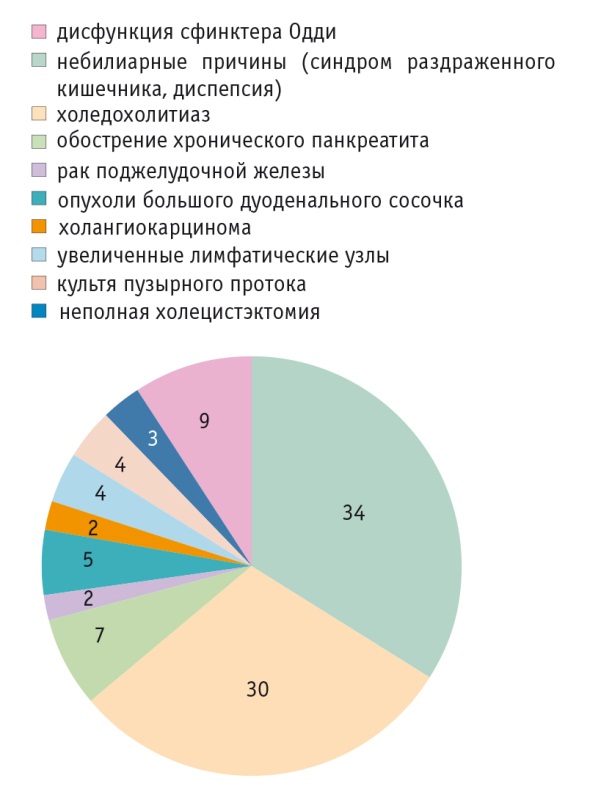
Объективное представление о структуре нозологий, являющихся причинами боли и диспепсии после холецистэктомии, позволяют сформировать результаты недавних клинических исследований. В одном из них в течение 36 месяцев находились под наблюдением 80 пациентов с симптомами боли и диспепсии после удаления желчного пузыря. Комплексное обследование с использованием биохимических тестов (билирубин и щелочная фосфатаза), трансабдоминального и эндоскопического УЗИ, эндоскопической ретроградной панкреатохолангиографии и манометрии сфинктера Одди позволило авторам точно определить причины боли и диспепсии у больных после холецистэктомии. Помимо функциональных расстройств, они включали в себя широкий спектр органических заболеваний гепатопанкреатобилиарной зоны. У бóльшей части (57,5%) пациентов имелась органическая патология билиопанкреатической зоны ( рис. ). При этом дисфункция сфинктера Одди и комплекс функциональных небилиарных причин (в том числе СРК) составили достаточно большую долю — 42,5% всех случаев (8,75% и 33,75% соответственно) [20].
Рис. Причины боли и диспепсии у пациентов с перенесенной холецистэктомией, %. Исследовательский центр гастроэнтерологии и гепатологии, Институт медицины и фармации, Крайова, Румыния (по [20])

По результатам исследования, проведенного в Великобритании с целью оценки частоты диареи у 100 пациентов, наблюдавшихся после холецистэктомии в течение 6-12 месяцев, у 17% из них этот симптом появился впервые и стал персистирующим только после хирургического вмешательства. В качестве наиболее достоверного фактора риска диареи после холецистэктомии авторы указали молодой возраст (ОШ — 3,4, 95%-й ДИ: 1,16-9,96, р = 0,026) [22]. Безусловно, именно у пациентов молодого и среднего возраста наиболее часто встречаются функциональные расстройства ЖКТ, включая СРК [8]. Одна из причин функциональных нарушений со стороны кишечника после холецистэктомии состоит в мальабсорбции желчных кислот и развитии секреторной диареи за счет избыточного и асинхронного поступления неконцентрированной желчи в просвет кишечной трубки. В основе патофизиологии секреторной диареи лежит и ускоренный пассаж содержимого по тонкой и толстой кишке, сопровождающийся гипермоторикой гладкой мускулатуры кишечника. Гипермоторика и спазм с появлением боли — весьма близкие в патофизиологическом плане состояния. Висцеральная гиперчувствительность, спазм (боль) и диарея формируют СРК-подобную симптоматику у некоторых больных после холецистэктомии. Психосоматический фон у части таких пациентов является фактором риска закрепления симптоматики [2].
Важно отметить еще одну работу, включавшую 158 пациентов, которым планировалось проведение лапароскопической холецистэктомии. Авторами оценивалось качество жизни и проверялось наличие СРК до и после оперативного лечения с использованием критериев СРК (критерии Маннинга и Римские критерии II) и опросника Gastrointestinal Quality of Life (GQL) соответственно. Как оказалось, у 32 (20,3%) пациентов был СРК до холецистэктомии [24], т. е. несколько чаще, чем в общей популяции (10-17%) [8]. Наблюдение за пациентами в общей выборке в сроки 6, 12 недель и 2 лет после оперативного лечения показало, что холецистэктомия в целом улучшает качество жизни пациентов в раннем восстановительном периоде после оперативного вмешательства. Так, средний балл GQL через 6 недель после операции значительно увеличился: с 88,8 ± 1,3 до 105,5 ± 1,3 (p < 0,001). Подобная картина сохранялась и через 3 месяца. Однако спустя 2 года после операции авторами отмечено значительное ухудшение качества жизни пациентов: в среднем на 7,6 ± 2,3 балла ниже значений до операции (p = 0,003). Вероятно, это произошло как раз за счет развития у части больных тех или иных отклонений, которые можно обозначить как ПХЭС. Важно, что у лиц, страдавших СРК до холецистэктомии, качество жизни ухудшалось уже к 6-й неделе после операции, вероятно, это происходило за счет усугубления симптоматики СРК. У таких больных наличие каждого симптома Маннинга снижало качество жизни на 5,2 ± 1,3 балла по сравнению с основной группой без СРК (p < 0,001). При использовании более современных Римских критериев II оказалось, что у лиц с СРК качество жизни снижается более выраженно — в среднем на 12 баллов по сравнению с общей группой пациентов [24].
Не удивительно, что в одном из крупнейших на сегодняшний день исследований, проведенном в клиниках Mayo (Рочестер, Миннесота) и Kaiser Permanente (Сан-Диего, Калифорния) и включавшем 1008 пациентов, перенесших холецистэктомию по поводу ЖКБ, были идентифицированы достоверные факторы отсутствия абдоминальной боли после оперативного вмешательства (p < 0,05) [38]:
редкая частота болевых приступов (1 раз в месяц и менее),Как видно из представленных выше факторов, они отнюдь не соответствуют признакам функциональных расстройств, для которых характерны длительное непрогрессирующее персистирование боли, частые кратковременные приступы или затяжные многодневные периоды боли умеренного характера, граничащей с дискомфортом, отсутствие болей в ночной период времени [7, 8, 18]. Более того, авторы цитируемой выше работы [38] отметили, что риск персистирования боли после холецистэктомии может повышаться у соматизированных пациентов, у лиц с болями внизу живота, рецидивирующим вздутием и другими маркерами СРК.
Таким образом, если у пациента был СРК до операции, то весьма возможно, что он сохранится и даже усугубится после оперативного вмешательства. Именно у такого пациента с высокой вероятностью можно ожидать повторных визитов к хирургу и гастроэнтерологу после операции с персистирующими жалобами на абдоминальную боль и симптомы диспепсии, расстройства стула и ухудшение качества жизни [2]. Экстраполируя эти данные, можно полагать, что холецистэктомия у больных ЖКБ, сочетающейся не только с СРК, но и с другими функциональными расстройствами ЖКТ, может иметь худший прогноз в отношении персистирования боли и диспепсии, чем у пациентов, которые страдают лишь ЖКБ.
Патофизиология постхолецистэктомических расстройств
Исходя из множества органических и функциональных причин боли и диспепсии после холецистэктомии, в патофизиологии постхолецистэктомических расстройств необходимо выделить органические и функциональные причины [2].
1. Органические причины:
боли, диспепсия и прочие симптомы, обусловленные органической патологией, связанной с ЖКБ и/или холецистэктомией (культя пузырного протока, холедохолитиаз, острый билиарный панкреатит, стриктуры холедоха и большого дуоденального сосочка и др.) [5],
2. Функциональные причины:
дисфункция (спазм) сфинктера Одди, имевшая место исходно или появившаяся/усугубившаяся после холецистэктомии (так называемый истинный ПХЭС),
Чтобы представить патофизиологию постхолецистэктомических расстройств, следует остановиться на функциях желчного пузыря (выпадающих после холецистэктомии) [1, 2]:
эвакуаторная функция обеспечивает выделение желчи в двенадцатиперстную кишку (ДПК) в пищеварительный период,
Итак, утрата желчного пузыря с потерей его функций и развитием вследствие этого дисфункции сфинктера Одди приводит к снижению качества и количества оттекающей желчи и панкреатического секрета в ДПК, что не всегда может полноценно компенсироваться работой физиологически сопряженных органов пищеварения. В связи с этим создаются реальные условия для пищеварительной дисфункции. Отчасти патогенез ПХЭС обусловлен выпадением функций желчного пузыря: отсутствие эвакуаторной и концентрационной функций определяет нарушение процессов липолиза в тонкой кишке, ослабление бактерицидных свойств желчи. Непрерывное желчеистечение также может определять дисфункцию пищеварения, способствовать формированию билиарных рефлюксов и развитию гипертонуса сфинктера Одди [1, 2, 5, 9].
Под влиянием измененной тонкокишечной микробиоты деконъюгируются желчные кислоты с последующим повреждением слизистой оболочки, развитием дуоденита, рефлюкс-гастрита и эзофагита. В ряде случаев дуоденит сопровождается дуоденальной гипертензией и дискинезией ДПК, что способствует персистированию патологических рефлюксов [2, 5].
Клиническая картина постхолецистэктомического синдрома
Боль после холецистэктомии, являясь главной причиной низкого качества жизни больных, исходит из многогранной патофизиологии постхолецистэктомических расстройств, представленной выше. Основная причина абдоминальной боли — функциональная перестройка сфинктерного аппарата желчных путей после утраты желчного пузыря.
Римским консенсусом III пересмотра хорошо представлена клиника трех типов дисфункции сфинктера Одди после холецистэктомии: билиарного, панкреатического и смешанного [18]. При изолированной дисфункции сфинктера холедоха возникают билиарные боли, локализующиеся в эпигастрии и/или правом подреберье с возможной иррадиацией в спину, правую лопатку. При преимущественном поражении сфинктера главного панкреатического протока типичными являются боли так называемого панкреатического типа, локализующиеся в эпигастрии и левом подреберье, порой иррадиирующие в поясничную область, спину. При спазме общего сфинктера отмечаются сочетанные билиарно-панкреатические боли, часто описываемые как «опоясывающие» [2, 9].
Тактика ведения и принципы лечения пациентов с постхолецистэктомическим синдромом
Базисом подходов к контролю боли и диспепсии после холецистэктомии служит своевременное и правильное установление их причин. Первоочередной задачей является исключение органической патологии органов пищеварения, которая может служить причиной жалоб, — холедохолитиаза, билиарных стриктур, опухолевых заболеваний билиопанкреатической зоны и др. Наличие подобных изменений, как правило, диктует необходимость хирургического или эндоскопического лечения. При отсутствии органических причин персистирования симптоматики следует думать о функциональном характере боли и диспепсии, особенно если имеется ассоциация с рядом косвенных маркеров функциональных болей [2]:
текущие симптомы имели место и до операции, а в послеоперационном периоде появились снова, с той же или даже с большей выраженностью,
Констатация факта функциональных расстройств органов пищеварения как причины боли и диспепсии после холецистэктомии является показанием к консервативному лечению. Основа выбора лекарственных средств для коррекции функциональных постхолецистэктомических спазмов и диспепсических расстройств эмпирическая, при этом большинство врачей предпочитают комбинированную фармакотерапию с обязательным использованием препаратов спазмолитического действия. Дополнительно могут назначаться средства для коррекции СИБР (кишечные антисептики, пищевые волокна, энтеросорбенты), дуоденогастрального рефлюкса (прокинетики, препараты урсодезоксихолевой кислоты, сорбенты), современные микрокапсулированные препараты панкреатина для коррекции вторичной панкреатической недостаточности и др.
К сожалению, унифицированных схем фармакотерапии ПХЭС не существует, что объясняется частым сочетанием (так называемым перекрестом) различных функциональных расстройств у одного больного, способных чередоваться во времени, а также наличием необязательных, но часто сопутствующих синдромов (СИБР и др.) после холецистэктомии. Следует отметить, что в случае доказанной дисфункции сфинктера Одди, резистентной к адекватному консервативному лечению в течение 3 месяцев, возможно эндоскопическое воздействие (эндоскопические папиллотомия и стентирование холедоха). Остальные случаи функциональных расстройств после холецистэктомии требуют консервативного лечения.
Выбор спазмолитика в рутинной практике также осуществляется эмпирическим путем, так как верифицировать тип моторных нарушений и провести фармакологические пробы с разными препаратами чрезвычайно сложно. Сравнительных контролируемых исследований, оценивающих эффект воздействия разных спазмолитиков на функцию сфинктера Одди, до сих пор не проведено. Ввиду того что из-за комбинации функциональных расстройств у одного и того же больного довольно сложно сепарировать жалобы, обусловленные дисфункцией сфинктера Одди, функциональной диспепсией и дуоденогастральным рефлюксом, СРК и СИБР, практикующими врачами, как правило, выбираются спазмолитики, способные ликвидировать спазм как в билиарном тракте, так и в кишечнике, приоритетно пролонгированного действия и с минимумом нежелательных явлений, что позволяет эффективно и безопасно использовать их долгосрочно.
Термин «постхолецистэктомический синдром» является крайне неудачным, в современной англоязычной литературе его заменяют «состоянием после холецистэктомии» ввиду широкого спектра органических и функциональных причин, определяющих персистирование основных проявлений — абдоминальной боли и диспепсии.
Риск развития функциональных расстройств после холецистэктомии повышен у лиц с исходными пограничными расстройствами психики, у пациентов молодого возраста с функционирующим желчным пузырем.
Лишь комплексное обследование больных с использованием биохимических тестов, трансабдоминального и эндоскопического УЗИ и/или эндоскопической ретроградной панкреатохолангиографии и манометрии сфинктера Одди позволяет детально определить причину боли и диспепсии у больных после холецистэктомии.
Основа выбора лекарственных средств для коррекции функциональных постхолецистэктомических спазмов и диспепсических расстройств эмпирическая, при этом большинство врачей предпочитают комбинированную фармакотерапию с обязательным использованием препаратов спазмолитического действия. В случае доказанной дисфункции сфинктера Одди, резистентной к адекватному консервативному лечению в течение 3 месяцев, возможны эндоскопические папиллотомия и стентирование холедоха.
"


